题目内容
6.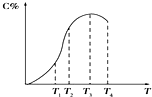 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
分析 T3之前,反应没有达到平衡状态,T3时反应达到平衡状态,T3后随温度升高,C%减小,平衡逆向移动,说明正反应放热,据此分析.
解答 解:A、根据温度越高反应速率越快,达到平衡所用时间越短,则在T3时,混合物中C的百分含量达到最大值,说明反应达到平衡,故A错误;
B、在T3时,反应达到平衡升高温度,此后C的百分含量减小,说明平衡向逆反应方向移动,故逆反应为吸热反应,则正反应为放热反应,故B错误;
C、在T3时,混合物中C的百分含量达到最大值,说明反应达到平衡,T3以后线上各点均是平衡点,所以温度为T4时,也达到了平衡,v正=v逆,故C错误;
D、在T3时,混合物中C的百分含量达到最大值,说明反应达到平衡,T3以后线上各点均是平衡点,故D正确;
故选D.
点评 本题考查了据图象分析平衡移动情况以及正逆反应速率问题,注意正逆反应速率的相对大小决定反应进行的方向.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16. 已知室温下,某些弱酸的电离常数如下:
已知室温下,某些弱酸的电离常数如下:
(1)常温下,物质的量浓度相同的下列四种溶液:
a.盐酸溶液 b.硫酸溶液 c.次氯酸溶液 d.醋酸溶液
①H+由大到小的顺序是:b、a、d、c(填字母)
②等体积a、b、d三种溶液与足量的锌完全反应,在相同的条件下,生成氢气的体积关系为b>a=d或b=2a=2d(用字母及“>”“<”“=”表示)
③欲降低稀硫酸与足量锌生成氢气速率,但不影响产生氢气的物质的量,下列措施可行的是abd
a.加水稀释 b.加入Na2SO4溶液 c.加入Na2CO3固体 d.加入CH3COONa固体
(2)某温度下pH均为4的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化如图所示,其中表示醋酸的曲线是b,该醋酸溶液稀释过程中,下列各量一定变小的是AC
A.c(H+) B.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ C.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)新制饱和氯水中存在Cl2+H2O?HCl+HClO,为使HClO浓度增大,下列措施可行的B
A.加少量NaOH固体 B.加CaCO3固体 C.加NaCl固体.
 已知室温下,某些弱酸的电离常数如下:
已知室温下,某些弱酸的电离常数如下:| CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.7×10-5 | Ka1=4.2.×10-7 Ka2=5.6.×10-11 | 3×10-8 |
a.盐酸溶液 b.硫酸溶液 c.次氯酸溶液 d.醋酸溶液
①H+由大到小的顺序是:b、a、d、c(填字母)
②等体积a、b、d三种溶液与足量的锌完全反应,在相同的条件下,生成氢气的体积关系为b>a=d或b=2a=2d(用字母及“>”“<”“=”表示)
③欲降低稀硫酸与足量锌生成氢气速率,但不影响产生氢气的物质的量,下列措施可行的是abd
a.加水稀释 b.加入Na2SO4溶液 c.加入Na2CO3固体 d.加入CH3COONa固体
(2)某温度下pH均为4的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化如图所示,其中表示醋酸的曲线是b,该醋酸溶液稀释过程中,下列各量一定变小的是AC
A.c(H+) B.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ C.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)新制饱和氯水中存在Cl2+H2O?HCl+HClO,为使HClO浓度增大,下列措施可行的B
A.加少量NaOH固体 B.加CaCO3固体 C.加NaCl固体.
17.A、B、C、D是四种短周期元素,它们的原子序数依次增大.其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物.请填写下列空白:
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:
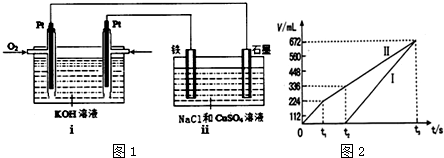
①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:

①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
11.下列说法正确的是( )
| A. | 分子里含有双键的有机物一定是烯烃 | |
| B. | 分子里含有苯环和羟基的化合物一定属于酚类 | |
| C. | 醛类的通式是CnH2nO(n≥1) | |
| D. | 相对分子质量为46的烃的含氧衍生物不一定是乙醇 |
18.下列关系不正确的是( )
| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
15.下列实验操作正确且能达到相应实验目的是( )
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 制备Fe(OH)3胶体 | 向氯化铁饱和溶液中逐滴加入少量NaOH溶液,加热煮沸至液体变为红褐色 |
| C | 证明碳酸的酸性强于硅酸 | CO2通入Na2SiO3溶液中,析出硅酸胶体 |
| D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |