题目内容
16. 已知室温下,某些弱酸的电离常数如下:
已知室温下,某些弱酸的电离常数如下:| CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.7×10-5 | Ka1=4.2.×10-7 Ka2=5.6.×10-11 | 3×10-8 |
a.盐酸溶液 b.硫酸溶液 c.次氯酸溶液 d.醋酸溶液
①H+由大到小的顺序是:b、a、d、c(填字母)
②等体积a、b、d三种溶液与足量的锌完全反应,在相同的条件下,生成氢气的体积关系为b>a=d或b=2a=2d(用字母及“>”“<”“=”表示)
③欲降低稀硫酸与足量锌生成氢气速率,但不影响产生氢气的物质的量,下列措施可行的是abd
a.加水稀释 b.加入Na2SO4溶液 c.加入Na2CO3固体 d.加入CH3COONa固体
(2)某温度下pH均为4的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化如图所示,其中表示醋酸的曲线是b,该醋酸溶液稀释过程中,下列各量一定变小的是AC
A.c(H+) B.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ C.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)新制饱和氯水中存在Cl2+H2O?HCl+HClO,为使HClO浓度增大,下列措施可行的B
A.加少量NaOH固体 B.加CaCO3固体 C.加NaCl固体.
分析 (1)①酸的电离平衡常数越大,酸的电离程度越大,相同浓度的不同酸,酸的电离平衡常数越大,该溶液中氢离子浓度越大;
②等物质的量的这三种酸分别与足量锌反应,生成氢气体积与最终电离出氢离子物质的量成正比;
③欲降低稀硫酸与足量锌生成氢气速率,但不影响产生氢气的物质的量,可以通过减小氢离子浓度实现,但加入的物质不能和酸反应生成其它气体;
(2)相同温度下,相同pH的盐酸和醋酸分别加水稀释,稀释过程中促进醋酸电离,所以稀释相同倍数时pH变化大的是盐酸,变化小的是醋酸;
加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,温度不变,水的离子积常数、醋酸电离平衡常数不变;
(3)新制饱和氯水中存在Cl2+H2O?HCl+HClO,为使HClO浓度增大,加入的物质要和盐酸反应但不能和HClO反应.
解答 解:(1)①酸的电离平衡常数越大,酸的电离程度越大,相同浓度的不同酸,酸的电离平衡常数越大,该溶液中氢离子浓度越大,盐酸和硫酸是强酸且硫酸是二元酸,醋酸电离程度大于HClO,所以溶液中氢离子浓度大小顺序是b、a、d、c,故答案为:b、a、d、c;
②等物质的量的这三种酸分别与足量锌反应,生成氢气体积与最终电离出氢离子物质的量成正比,醋酸和盐酸最终电离出氢离子物质的量相等,硫酸电离出氢离子物质的量最多,所以生成氢气体积关系是b>a=d或b=2a=2d,故答案为:b>a=d或b=2a=2d;
③欲降低稀硫酸与足量锌生成氢气速率,但不影响产生氢气的物质的量,可以通过减小氢离子浓度实现,但加入的物质不能和酸反应生成其它气体,
a.加水稀释导致氢离子浓度降低但氢离子总量不变,所以符合条件,故正确;
b.加入Na2SO4溶液相当于加水稀释,氢离子浓度降低但总量不变,所以符合条件,故正确;
c.加入Na2CO3固体,碳酸钠和醋酸反应生成二氧化碳,所以减少氢气生成量,不符合条件,故错误;
d.加入CH3COONa固体,生成弱电解质醋酸,导致氢离子浓度降低,但氢离子总量不变,所以符合条件,故正确;
故选abd;
(2)相同温度下,相同pH的盐酸和醋酸分别加水稀释,稀释过程中促进醋酸电离,所以稀释相同倍数时pH变化大的是盐酸,变化小的是醋酸,所以b表示醋酸;
A.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,故正确;
B.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(O{H}^{-}).c({H}^{+}).c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a}}$,温度不变,离子积常数、电离平衡常数不变,所以二者比值不变,故错误;
C.加水稀释促进醋酸电离,氢离子物质的量增大、醋酸分子物质的量减小,溶液体积相同,所以$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
减小,故正确;
故答案为:b;AC;
(3)新制饱和氯水中存在Cl2+H2O?HCl+HClO,为使HClO浓度增大,加入的物质要和盐酸反应但不能和HClO反应,
A.加少量NaOH固体,盐酸和次氯酸都和氢氧化钠反应,不符合条件,故错误;
B.加CaCO3固体,只有盐酸反应,所以次氯酸浓度增大,故正确;
C.加NaCl固体,都不和氯化钠反应,不符合条件,故错误;
故选B.
点评 本题考查酸碱混合溶液定性判断、弱电解质的电离等知识点,为高频考点,明确弱电解质电离特点是解本题关键,注意(2)题B中分式的换算,为易错点.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 碳酸氢钠溶液跟过量的饱和石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液显中性H++SO42-+-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气 Fe2++Cl2═Fe3++2Cl- | |
| D. | 苛性钾溶液中加入稀盐酸 H++OH-═H2O |
| A. | NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+SO32-+2H2O | |
| B. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6H++5H2O2═2Mn2++5 O2↑+8H2O | |
| D. | 用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
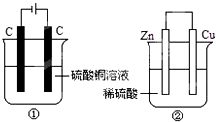 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阳极:4OH --4e -═2H2O+O2↑ ②中负极:2H ++2e -═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |
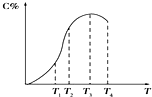 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
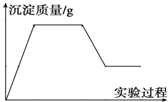 有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)