题目内容
6.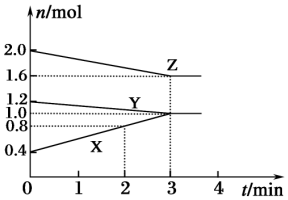 某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题:(1)该反应的化学方程式为Y+2Z?3X.
(2)反应开始至2min 末,X的反应速率为$\frac{1}{15}$mol/(L•min).
(3)该反应是由正、逆反应同时(填“正反应”、“逆反应”或“正、逆反应同时”)开始反应的.
(4)平衡时,Z的转化率.20%
(5)起始与平衡时的压强之比1:1.
分析 (1)反应中浓度的变化写出化学方程式,变化量之比等于化学方程式计量数之比;
(2)2min内X浓度的变化计算得出X的反应速率=$\frac{△c}{△t}$;
(3)根据平衡开始时,各物质的物质的量判断;
(4)转化率=$\frac{消耗量}{起始量}$×100%;
(5)气体压强之比等于气体物质的量之比;
解答 解:(1)根据图象可知Y、Z浓度降低,为反应物,X浓度增大为生成物,当物质的量不再变化时,达到平衡状态,此时△n(Y)=1.2mol-1.0mol=0.2mol,△n(Z)=2.0mol-1.6mol=0.4mol,△n(X)=1.0mol-0.4mol=0.6mol,计量数之比等于△n(Y):△n(Z):△n(X)=1:2:3,化学方程式可写为Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,△n(X)=0.8mol-0.4mol=0.4mol,△c(X)=$\frac{0.4mol}{3L}$=$\frac{0.4}{3}$mol/L,化学反应速率为$\frac{\frac{0.4}{3}mol/L}{2min}$=$\frac{1}{15}$mol/(L•min),
故答案为:$\frac{1}{15}$mol/(L•min);
(3)反应刚开始时,反应物和生成物物质的量均不为零,即化学平衡是由正、逆反应同时开始反应的,
故答案为:正、逆反应同时;
(4)Z的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{2.0mol-1.6mol}{2.0mol}$×100%=20%,
故答案为:20%;
(5)开始气体物质的量总和=2.0mol+1.2mol+0.4mol=3.6mol,平衡状态下气体物质的量总和=1.0mol+1.0mol+1.6mol=3.6mol,起始与平衡时的压强之比等于气体物质的量之比=3.6:3.6=1:1,
故答案为:1:1;
点评 本题考查化学平衡的变化图象,题目难度不大,本题注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案| A. | c( NH4+)相等的NH4Cl溶液和(NH4)2Fe( SO4)2溶液中:c(Cl-)>c( SO42-) | |
| B. | 常温下,将pH=5的H2S04溶液加水稀释1000倍,所得溶液的pH=8 | |
| C. | 0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合所得的溶液中:c( CH3COOH)+c( CH3COO -)=2c(Na+)=0.2 mol/L | |
| D. | 用甲基橙作指示剂,用标准盐酸滴定未知浓度的氨水,至终点时,溶液中:c(NH4+)=c(Cl-) |
| A. | 分子内共价键 | B. | 分子间的作用力 | ||
| C. | 分子间的距离 | D. | 分子内共价键的键长 |
| A. | C与CO2能继续反应 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与足量盐酸反应放出气体 | D. | 受热易分解 |
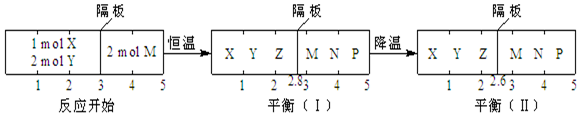
下列判断正确的是( )
| A. | 反应①的正反应是吸热反应 | |
| B. | 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 | |
| C. | 达平衡(I)时,X的转化率为$\frac{5}{11}$ | |
| D. | 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变 |
| t∕min | 2 | 4 | 7 | 9 |
| n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前4min的平均反应速率υ(Z)=0.0125 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大 |
| A. | 某溶液加入足量NaOH溶液,加热产生碱性的气体,溶液一定是铵盐溶液 | |
| B. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | NO2和SO2都能使湿润的蓝色的石蕊试纸变红后褪色 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液可能有可能有SO32- |
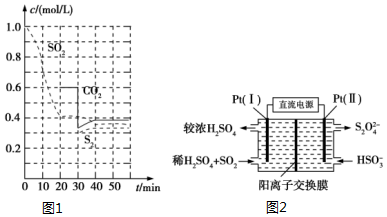 SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法: