题目内容
13.下列叙述正确的是( )| A. | c( NH4+)相等的NH4Cl溶液和(NH4)2Fe( SO4)2溶液中:c(Cl-)>c( SO42-) | |
| B. | 常温下,将pH=5的H2S04溶液加水稀释1000倍,所得溶液的pH=8 | |
| C. | 0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合所得的溶液中:c( CH3COOH)+c( CH3COO -)=2c(Na+)=0.2 mol/L | |
| D. | 用甲基橙作指示剂,用标准盐酸滴定未知浓度的氨水,至终点时,溶液中:c(NH4+)=c(Cl-) |
分析 A.(NH4)2Fe( SO4)2溶液中亚铁离子水解显酸性抑制铵根离子水解;
B.酸溶液稀释溶液PH最大程度为PH接近7;
C.0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合得到等浓度的醋酸钠和醋酸的混合溶液,溶液中存在物料守恒;
D.用甲基橙作指示剂,变色范围为3.1-4.4,用标准盐酸滴定未知浓度的氨水,至终点时溶液显酸性,结合溶液中电荷守恒判断;
解答 解:A.(NH4)2Fe( SO4)2溶液中亚铁离子水解显酸性抑制铵根离子水解,c( NH4+)相等的NH4Cl溶液和(NH4)2Fe( SO4)2溶液中:c(Cl-)>c( SO42-),故A正确;
B.常温下,将pH=5的H2S04溶液加水稀释1000倍,所得溶液的pH接近7,但不能超过8显碱性,故B错误;
C.0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合得到等浓度的醋酸钠和醋酸的混合溶液,溶液中存在物料守恒c( CH3COOH)+c( CH3COO -)=2c(Na+)=0.1 mol/L,故C错误;
D.用甲基橙作指示剂,变色范围为3.1-4.4,用标准盐酸滴定未知浓度的氨水,至终点时溶液显酸性,c(H+)>c(OH-),溶液中电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),得到c(NH4+)<c(Cl-),故D错误;
故选A.
点评 本题考查了电解质溶液中电荷守恒、物料守恒、离子浓度大小、弱电解质溶液稀释电离平衡影响因素等,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
3.下列各组离子在指定溶液中能大量共存的是( )
| A. | 酸性溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | 硫酸钠的溶液中:Mg2+、K+、HCO3-、NO3- | |
| C. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| D. | 加入FeCl3溶液:I-、NH4+、Cl-、Ba2+ |
1.常温下,下列各组离子在相应的条件下可能大量共存的是( )
| A. | pH=2的溶液中:S2O32-、K+、Cl-、Na+ | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=10-10 mol/L的溶液中:Na+、HCO3-、Cl-、K+ | |
| C. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
8.由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是( )
| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
5.HA为酸性略强于醋酸的一元弱酸,在等浓度的 NaA和HA的混合溶液中,离子浓度关系一定不正确的是( )
| A. | c(Na+)+c(H+)=c(A-)+c(OH-) | B. | c(A-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | 2c(Na+)=c(A-)+c(HA) | D. | c(Na+)>c(A-)>c(H+)>c(OH-) |
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.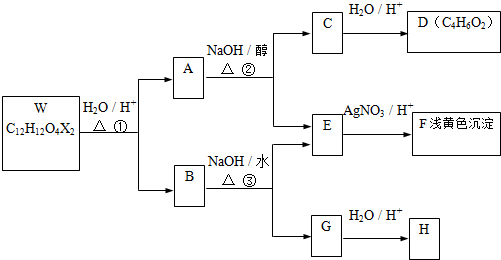

 .
.
 .
.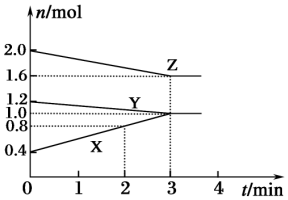 某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题: