题目内容
14. SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g)?S2(g)+2CO2(g).
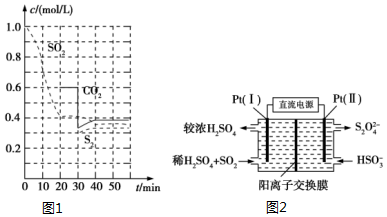
反应进行到不同时间测得各物质的浓度如图1:
①0~20min反应速率表示为v(SO2)=0.03mol/(L•min);
②30min时,改变某一条件平衡发生移动,则改变的条件最有可能是减少CO2的浓度;
③能说明上述反应达到平衡状态的是bc.
a.SO2 的消耗速率与CO2 的生成速率相同 b.混合气体的密度不变
c.S2的浓度不变 d.SO2 与S2的物质的量之比为2:1
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为SO32-+SO2+H2O=2HSO3-;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是abc(填序号).
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-8 mol/L
(3)电化学处理法
①如图2所示,Pt(Ⅰ)电极的电极反应式为SO2-2e-+2H2O=SO42-+4H+;
②当电路中转移0.02mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加0.03mol离子.
分析 (1)①根据v=$\frac{△c}{△t}$计算v(SO2);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度;
③可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠;
②a.根据电荷守恒判断;
b.根据物料守恒判断;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4H+,根据电子转移守恒计算生成硫酸根、氢离子的物质的量,为保持溶液电中性,多余的氢离子通过阳离子交换膜移至右侧,左侧溶液中增加离子为生成硫酸电离的离子总量.
解答 解:(1)①由图可知,0-20min内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故v(SO2)=$\frac{0.6mol/L}{20min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度,
故答案为:减少CO2的浓度;
③2C(s)+2SO2(g)?S2(g)+2CO2(g)
a.SO2 的消耗速率与CO2 的生成速率相同,只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量变化,体积不变,混合气体的密度不变说明反应达到平衡状态,故b正确;
c.S2的浓度不变是平衡标志,故c正确;
d.SO2 与S2的物质的量之比为2:1不能说明反应达到平衡状态,故d错误;
故答案为:bc;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32-+SO2+H2O=2HSO3-,
故答案为:SO32-+SO2+H2O=2HSO3-;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正确;
b.溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),故b正确;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故c正确;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故d错误,
故答案为:abc;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO2-2e-+2H2O=SO42-+4H+,
故答案为:SO2-2e-+2H2O=SO42-+4H+;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,根据电子转移守恒,生成硫酸根物质的量 $\frac{0.02mol}{2}$=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol,
故答案为:0.03.
点评 本题属于拼合型题目,涉及反应热计算、反应速率计算、化学平衡影响因素、离子浓度比较、电极反应式书写、电解池有关计算等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,(3)中左侧溶液中增加离子物质的量计算为易错点,学生容易根据电极反应式计算,忽略部分氢离子移至右侧,题目难度中等.

| A. | pH=2的溶液中:S2O32-、K+、Cl-、Na+ | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=10-10 mol/L的溶液中:Na+、HCO3-、Cl-、K+ | |
| C. | 在$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
| A. | c(Na+)+c(H+)=c(A-)+c(OH-) | B. | c(A-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | 2c(Na+)=c(A-)+c(HA) | D. | c(Na+)>c(A-)>c(H+)>c(OH-) |
| A. | H3+的电子式为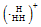 | |
| B. | H3+可进行反应,在液态氢中形成H4+、H6+、H8+ | |
| C. | H3+可在液态氢中形成H5+、H7+、H9+ | |
| D. | H3+广泛存在于固态、液态和气态氢中 |
①烯烃被酸性KMnO4溶液氧化 ②乙苯被酸性KMnO4溶液氧化 ③重油裂化为汽油
④CH3COONa跟碱石灰共热 ⑤炔烃使溴水褪色.
| A. | ①③④ | B. | ③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
| A. | HNO3 | B. | Na2O | C. | A1C13 | D. | CO2 |
| A. | 阳离子一定是金属离子,阴离子一定只含非金属元素 | |
| B. | 金属阳离子一定只具有氧化性,没有还原性 | |
| C. | 阴、阳离子相互作用后不一定形成离子化合物 | |
| D. | 金属和非金属化合一定生成离子化合物 |
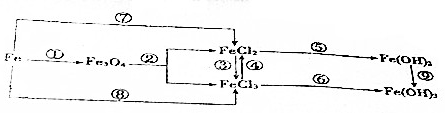
| A. | ③反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钢铁腐蚀时,负极发生的反应是Fe-3e-═Fe3+ | |
| C. | 以Fe为电极,电解饱和NaCl溶液,阳极反应式为2Cl--2e-═Cl2↑ | |
| D. | FeCl2溶液中混有少量FeCl3,可以加入Fe、Cu等金属除去FeCl3 |
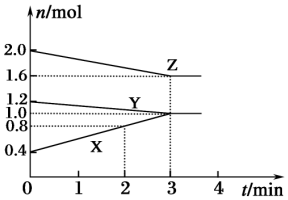 某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题: