题目内容
16.下列叙述中中正确的是( )| A. | 某溶液加入足量NaOH溶液,加热产生碱性的气体,溶液一定是铵盐溶液 | |
| B. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | NO2和SO2都能使湿润的蓝色的石蕊试纸变红后褪色 | |
| D. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液可能有可能有SO32- |
分析 A.铵根离子与NaOH加热生成氨气;
B.具有强氧化性的气体可氧化KI;
C.SO2为酸性氧化物;
D.白色沉淀为AgCl或硫酸钡.
解答 解:A.铵根离子与NaOH加热生成氨气,则溶液一定是铵盐溶液,故A正确;
B.具有强氧化性的气体可氧化KI,则能使润湿的淀粉KI试纸变成蓝色的物质是Cl2或臭氧等,故B错误;
C.SO2为酸性氧化物,使湿润的蓝色的石蕊试纸变红,而NO2能使湿润的蓝色的石蕊试纸变红后褪色,故C错误;
D.白色沉淀为AgCl或硫酸钡,则溶液可能有可能有SO42-,或银离子,但二者不能同时存在,故D错误;
故选A.
点评 本题考查物质的鉴别和检验,为高频考点,把握离子检验方法、物质的性质为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
7.下列物质不能通过化合反应制得的是( )
| A. | MgCl2 | B. | Fe(OH)3 | C. | SO3 | D. | Al(OH)3 |
4.在元素Fe单质及其化合物变化中,下列说法正确的是( )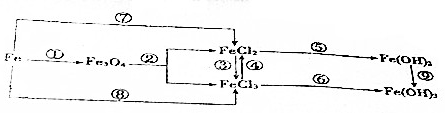

| A. | ③反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钢铁腐蚀时,负极发生的反应是Fe-3e-═Fe3+ | |
| C. | 以Fe为电极,电解饱和NaCl溶液,阳极反应式为2Cl--2e-═Cl2↑ | |
| D. | FeCl2溶液中混有少量FeCl3,可以加入Fe、Cu等金属除去FeCl3 |
11.固体单质X和气体Y在容积一定的密闭容器中完全反应生成气体Z,相同温度下测得容器内压强不变,若产物气体Z的密度是原气体密度的3倍,则判断正确的是( )
| A. | 反应前后的气体质量之比一定是1:3 | |
| B. | 两种单质X、Y的摩尔质量之比是1:3 | |
| C. | 在生成物Z中,X的质量分数为50% | |
| D. | Z中X、Y两元素的原子个数比为3:1 |
8.下列各组离子在溶液中能大量共存,且加入铝粉一定能放出氢气的是( )
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、SO42- | D. | Na+、Mg2+、NO3-、OH- |
9.两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )
| A. | Zn、Al | B. | Fe、Zn | C. | Al、Mg | D. | Mg、Cu |
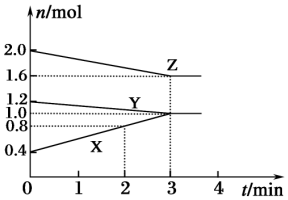 某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题: