题目内容
18.在一定温度下,有a.盐酸 b.硫酸 c.醋酸 三种稀溶液:(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c.(填字母,下同)
(2)相同体积、相同物质的量浓度的三种酸,分别用相同浓度的NaOH溶液完全中和,所需NaOH溶液的体积由大到小的顺序是b>a=c.
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是a=b>c.
(4)当三种溶液的c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是c>a=b.
分析 (1)物质的量浓度相等的酸,硫酸和氯化氢是强电解质,完全电离,醋酸是一元弱酸,部分电离,据此确定氢离子浓度大小;
(2)同体积同物质的量浓度的三种酸,氢的物质的量越大,需要的氢氧化钠的物质的量越大;
(3)强酸溶液稀释100倍,氢离子浓度变为原来的$\frac{1}{100}$,弱酸溶液稀释100倍,氢离子浓度变为大于原来的$\frac{1}{100}$;
(4)c(H+)相同、体积相同时,生成氢气体积大小与最终氢离子的物质的量成正比.
解答 解:(1)氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,
故答案为:b>a>c;
(2)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,所需NaOH溶液的体积由大到小的顺序是b>a=c;
故答案为:b>a=c;
(3)强酸溶液稀释100倍,氢离子浓度变为原来的$\frac{1}{100}$,弱酸溶液稀释100倍,氢离子浓度变为大于原来的$\frac{1}{100}$,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b,则pH由大到小的顺序是a=b>c,
故答案为:a=b>c;
(4)当c(H+)相同、体积相同时,醋酸的浓度最大,反应过程中生成的氢离子最多,盐酸和硫酸中氢离子的物质的量相等,所以分别加入足量锌,生成氢气体积为c>a=b;
故答案为:c>a=b.
点评 本题考查了弱电解质的电离及溶液中离子浓度大小的比较,根据电解质的强弱及酸的元数来分析解答即可,难度不大,注意弱电解质稀释时溶液中各种离子浓度的变化,为易错点.

①烯烃被酸性KMnO4溶液氧化 ②乙苯被酸性KMnO4溶液氧化 ③重油裂化为汽油
④CH3COONa跟碱石灰共热 ⑤炔烃使溴水褪色.
| A. | ①③④ | B. | ③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
| A. | 滤液中一定有Fe2(SO4)3和FeSO4 | |
| B. | 滤液中可能有CuSO4,一定有FeSO4、ZnSO4 | |
| C. | 滤渣中一定有Cu和Fe,一定无Zn | |
| D. | 滤渣中可能有Cu、Fe和Zn |
| A. | 阳离子一定是金属离子,阴离子一定只含非金属元素 | |
| B. | 金属阳离子一定只具有氧化性,没有还原性 | |
| C. | 阴、阳离子相互作用后不一定形成离子化合物 | |
| D. | 金属和非金属化合一定生成离子化合物 |
| A. | MgCl2 | B. | Fe(OH)3 | C. | SO3 | D. | Al(OH)3 |
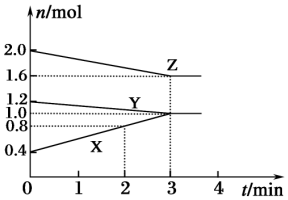 某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.分析图中数据,回答下列问题: