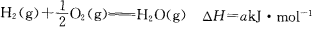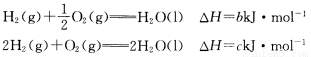题目内容
2.常温下,pH=3的盐酸aL分别与下列3种溶液混合,充分反应后溶液呈中性①pH=11的氨水bL
②物质的量浓度为1×10-1mol•L-1的氨水cL
③c(OH)=1×10-3mol•L-1的Ba(OH)2溶液dL.
试判断a、b、c、d大小关系正确的为( )
| A. | c>a=d>b | B. | b>a=d>c | C. | c>a>b>d | D. | a=b>c>d |
分析 HCl、Ba(OH)2都是强电解质,在水溶液中完全电离,NH3.H2O是弱电解质,在水溶液中部分电离,
常温下pH=3的盐酸溶液中c(H+)=0.001mol/L,
①NH3.H2O是弱电解质,所以常温下pH=11的c(NH3.H2O)>c(OH-)=0.001mol/L;
②中c(OH-)<c(NH3.H2O)=0.1mol/L;
③中c(OH-)=1×10-3mol•L-1;
氯化铵是强酸弱碱盐,其水溶液呈碱性,要使混合溶液呈中性,氨水物质的量应该稍微过量;
氯化钡是强酸强碱盐,其水溶液呈中性,要使混合溶液呈中性,则酸中氢离子物质的量等于碱中氢氧根离子物质的量,则a=d;盐酸的物质的量相等,消耗氨水体积与其浓度成反比.
解答 解:HCl、Ba(OH)2都是强电解质,在水溶液中完全电离,NH3.H2O是弱电解质,在水溶液中部分电离,
常温下pH=3的盐酸溶液中c(H+)=0.001mol/L,
①NH3.H2O是弱电解质,所以常温下pH=11的c(NH3.H2O)>c(OH-)=0.001mol/L;
②中c(OH-)<c(NH3.H2O)=0.1mol/L;
③中c(OH-)=1×10-3mol•L-1;
氯化铵是强酸弱碱盐,其水溶液呈碱性,要使混合溶液呈中性,氨水物质的量应该稍微过量,所以消耗体积c>a;
氯化钡是强酸强碱盐,其水溶液呈中性,要使混合溶液呈中性,则酸中氢离子物质的量等于碱中氢氧根离子物质的量,则a=d;
盐酸的物质的量相等,消耗氨水体积与其浓度成反比,氨水浓度①>②,所以消耗氨水体积c>b;
通过以上分析知,溶液体积大小顺序是c>a=d>b,故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确弱电解质电离特点是解本题关键,知道各物质浓度之间关系即可解答,题目难度不大.

 口算题天天练系列答案
口算题天天练系列答案| A. | 产生BaSO4白色沉淀,溶液变红色 | B. | 产生BaSO3白色沉淀,溶液变无色 | ||
| C. | 无沉淀产生,溶液变无色 | D. | 产生BaSO4白色沉淀,溶液变无色 |
| A. | 1 L0.1mol/L的NaHCO3溶液中含CO32-数目为0.1NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05 NA | |
| C. | 2.7g铝投入到一定量的稀盐酸中,一定产生0.15NA个H2 | |
| D. | Fe在足量Cl2中燃烧,转移电子数为3NA |
| A. |  比较苏打和小苏打的热稳定性 比较苏打和小苏打的热稳定性 | B. |  检查装置气密性 检查装置气密性 | ||
| C. |  向容量瓶转移液体 向容量瓶转移液体 | D. |  用苯从碘水中分离出碘 |

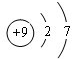 ,C2-的电子式
,C2-的电子式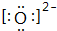 .
. .
.