题目内容
11.常温下,下列溶液中的微粒浓度关系正确的是( )| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:c(H+)+C(CH3COOH)<C(CH3COO-)+c(OH-) |
分析 A.溶液中存在电荷守恒分析判断;
B.pH=8.3的NaHCO3溶液显碱性,碳酸氢根离子水解大于电离;
C.pH=11的氨水与pH=3的盐酸等体积混合,一水合氨又电离出铵根离子和氢氧根离子溶液显碱性;
D.0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合得到等浓度的醋酸和醋酸钠混合溶液,醋酸电离大于醋酸根离子水解溶液显酸性,c(Na+)>C(CH3COOH),结合溶液中电荷守恒分析判断.
解答 解:A.新制氯水中加入固体NaOH,溶液中存在电荷守恒,c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),则A错误;
B.pH=8.3的NaHCO3溶液显碱性,碳酸氢根离子水解大于电离,c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.pH=11的氨水与pH=3的盐酸等体积混合,一水合氨又电离出铵根离子和氢氧根离子溶液显碱性,c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合得到等浓度的醋酸和醋酸钠混合溶液,醋酸电离大于醋酸根离子水解溶液显酸性,c(Na+)>C(CH3COOH),结合溶液中电荷守恒分析判断,c(H+)+C(Na+)=C(CH3COO-)+c(OH-),c(H+)+C(CH3COOH)<C(CH3COO-)+c(OH-),故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断、弱电解质的电离平衡及其影响,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握影响弱电解质电离平衡的因素,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列实验方法正确的是( )
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 要检验某溶液中是否含Fe3+可加入铁粉 | |
| C. | 新制的氯水中可用PH试纸准确测定其PH值 | |
| D. | 某气体能使品红溶液褪色,该气体一定为SO2 |
6.常温下,向10mL 0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( )
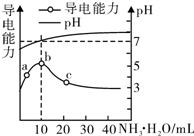

| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c点溶液存在c( NH4+)>c( R-)、c(OH-)>c(H+) | |
| D. | b~e任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
16.化学与生活密切相关,下列说法正确的是( )
| A. | 生活中常用热的小苏打去污,利用了水解吸热的特点 | |
| B. | Mg可由电解MgCl2水溶液制取,Al可由电解熔融Al2O3制取 | |
| C. | 少数商贩在蔬菜表面洒少许福尔马林,可延长保鲜时间 | |
| D. | SiO2可用来制作光导纤维,但SiO2本身不导电 |
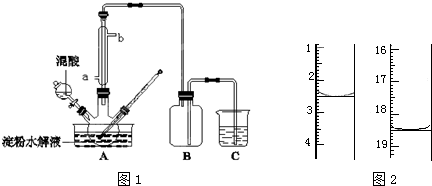
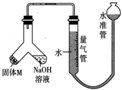 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验. .
. .
.