题目内容
16.化学与生活密切相关,下列说法正确的是( )| A. | 生活中常用热的小苏打去污,利用了水解吸热的特点 | |
| B. | Mg可由电解MgCl2水溶液制取,Al可由电解熔融Al2O3制取 | |
| C. | 少数商贩在蔬菜表面洒少许福尔马林,可延长保鲜时间 | |
| D. | SiO2可用来制作光导纤维,但SiO2本身不导电 |
分析 A.苏打水解碱性强,加热促进苏打水解,且碱性增强利用油污水解;
B.电解熔融氯化镁制取Mg;
C.福尔马林为HCHO的水溶液,HCHO有毒;
D.二氧化硅具有对光良好的全反射作用,可用作光导纤维的材料.
解答 解:A.加热促进苏打水解,且碱性增强利用油污水解,则生活中常用热的苏打去污,利用了水解吸热及油污在碱性条件下水解为不可逆反应,一般不用小苏打,故A错误;
B.电解熔融氯化镁制取Mg,Al可由电解熔融Al2O3制取,故B错误;
C.福尔马林为HCHO的水溶液,HCHO有毒,不能用作蔬菜保鲜,故C错误;
D.二氧化硅具有对光良好的全反射作用,可用作光导纤维的材料,但SiO2本身不导电,故D正确;
故选D.
点评 本题考查物质的性质、应用等,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,综合性较强,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
6.下列官能团的名称和写法都正确的是( )
| A. | 羟基(OH-) | B. | 碳碳双键(C=C) | C. | 醛基(-COH) | D. | 羰基( ) ) |
7.为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
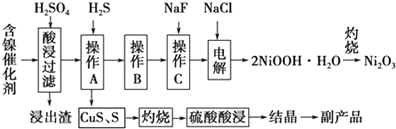
已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.

已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
11.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:c(H+)+C(CH3COOH)<C(CH3COO-)+c(OH-) |
5.等物质的量的下列化合物充分反应后得到的O2质量最多的是( )
| A. | KClO3(MnO2,加热) | B. | KMnO4(加热) | C. | H2O2(MnO2) | D. | HgO(加热) |
6.下列实验方法正确的是( )
| A. | 通过测定沸点区别生物柴油和矿物柴油 | |
| B. | 用水区别乙酸、溴苯和硝基苯 | |
| C. | 用溴水区别环己烷、甲苯和环己烯 | |
| D. | 用燃烧法区别乙醇、苯和四氯化碳 |
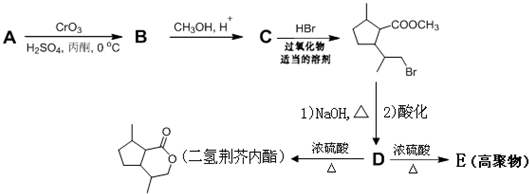
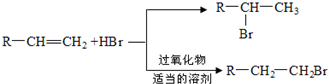
 ,D中含有的官能团的名称羧基、羟基.
,D中含有的官能团的名称羧基、羟基.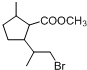 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$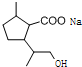 +CH3OH+NaBr.
+CH3OH+NaBr.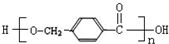 )的路线补全完整
)的路线补全完整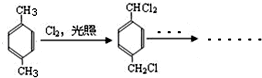
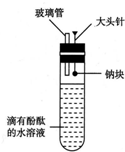 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: