题目内容
3.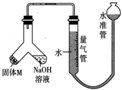 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.
某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验.(1)如何检验该装置的气密性?
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式是2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑.
(3)倾斜左边装置使氢氧化钠溶液(足量)与质量为a的合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为V(已折算成标准状况).若量气管最大量为50 mL,则固体M中铝的质量[m(Al)]范围为0<mAl<0.04g.
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积>(填“>”“<”或“=”)V.
(5)若a=38 mg,V=44.8 mL(标准状况),通过计算可知,该合金符合(填“符合”或“不符合”)国家标准.
分析 (1)检验装置的气密性常用方法为利用气体的热胀冷缩或液封气体形成液面高度差,由装置图可知适合选择液封气体形成液面高度差,一定时间,液面高度差保持不变,说明气密性良好;
(2)铝与氢氧化钠、水反应生成四羟基合铝酸钠、氢气;
(3)量气管最大量程为50mL,则产生氢气的增大体积为50mL,计算氢气的最大物质的量,根据电子转移守恒可知3n(Al)=2n(H2),据此计算铝的最大质量;
(4)Mg、Al都与盐酸反应生成氢气,改用盐酸生成气体体积增大;
(5)根据氢气的体积V=44.8mL计算氢气的物质的量,根据电子转移守恒可知3n(Al)=2n(H2),据此计算铝的质量,再计算Al的质量分数,据此判断.
解答 解:(1)检验装置的气密性常用方法为利用气体的热胀冷缩或液封气体形成液面高度差,由装置图可知适合选择液封气体形成液面高度差,检验该装置气密性的方法为:安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封,
故答案为:安装好装置并在量气管内加人水,向下移动水准管,静置片刻,若水准管中液面与量气管液面维持一定的高度差,说明装置密封;
(2)铝与氢氧化钠、水反应生成四羟基合铝酸钠、氢气,反应离子方程式为2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑,
故答案为:2OH-+2Al+6H2O═2[Al(OH)4]-+3H2↑;
(3)量气管最大量程为50mL,则产生氢气的增大体积为50mL,所以氢气的最大物质的量为$\frac{0.05L}{22.4L/mol}$=$\frac{0.05}{22.4}$mol,根据电子转移守恒可知3n(Al)=2n(H2)=$\frac{0.05}{22.4}$mol×2,故铝的最大质量为$\frac{1}{3}$×$\frac{0.05}{22.4}$mol×2×27g/mol=0.04g,所以金属铝的质量范围为0<mAl<0.04g,
故答案为:0<mAl<0.04g;
(4)Mg、Al都与盐酸反应生成氢气,改用盐酸生成氢气的体积增大,故答案为:>;
(5)44.8mL氢气的物质的量为$\frac{0.0448L}{22.4L/mol}$=0.002mol,根据电子转移守恒可知3n(Al)=2n(H2)=0.002mol×2=0.004mol,所以合金中铝的质量$\frac{1}{3}$×0.004mol×27g/mol=0.036g,合金中Al的质量分数为$\frac{0.036g}{0.038g}$×100%=94.74%>78%,故该合金符合标准,
故答案为:符合.
点评 本题考查学生对实验原理与实验装置的理解、元素化合物性质、物质组成测定、化学计算等,难度中等,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

| A. | 1 mol | B. | 5 mol | C. | 6 mol | D. | 2 mol |
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1NaOH溶液等体积混合:c(H+)+C(CH3COOH)<C(CH3COO-)+c(OH-) |
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 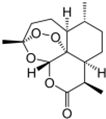 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物总质量之比 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
| A. | 作净水剂的明矾和作消毒剂的漂白粉都是强电解质 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 |
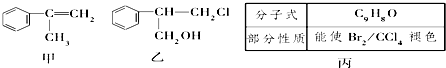
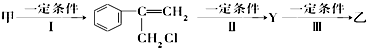
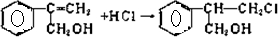 (不需注明反应条件).
(不需注明反应条件).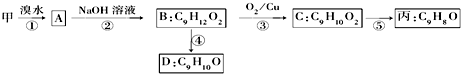
 .
. 、
、 、
、 (任写一种).
(任写一种).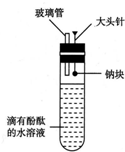 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: