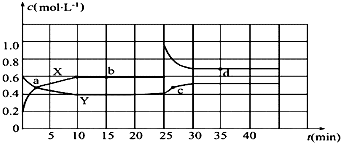
题目内容
17. 某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.
某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.(1)该蓄电池充电时,发生还原反应的物质是Fe(OH)2.
(2)放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是0.4mol.
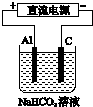
(3)以该蓄电池作电源,用如右图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)
Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3+3CO2.
(4)精炼铜时,粗铜应与直流电源的正极(填“正”或“负”)相连,阴极的电极反应式为Cu2++2e=Cu.
分析 (1)充电时阴极上得电子发生还原反应;
(2)根据氢氧化亚铁和转移电子之间的关系式计算;
(3)阳极上铝失电子生成铝离子,铝离子和碳酸氢根离子发生双水解反应;
(4)精炼粗铜时,粗铜作阳极、纯铜作阴极,据此回答.
解答 解:(1)充电时,阴极上Fe(OH)2得电子生成Fe而发生还原反应,故答案为:Fe(OH)2;
(2)转移电子物质的量=$\frac{18g}{90g/mol}$(2-0)=0.4mol,
故答案为:0.4;
(3)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al=Al3++3e-、Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)精炼粗铜时,粗铜作阳极、纯铜作阴极,所以粗铜与电源正极相连,阴极发生得电子的还原反应,发生反应的电极反应式为:Cu2++2e=Cu;
故答案为:正;Cu2++2e=Cu.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,难点是铝离子和碳酸氢根离子发生双水解的反应,题目难度不大.

练习册系列答案
相关题目
1.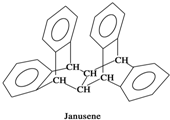 如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )
 如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )
如图是一种形状酷似罗马两面神Janus的有机物结构简式,化学家建议将该分子叫做“Janusene”,下列说法正确的是( )| A. | Janusene的分子式为C30H20 | |
| B. | Janusene属于苯的同系物 | |
| C. | Janusene苯环上的一氯代物有8种 | |
| D. | Janusene既可发生氧化反应,又可发生还原反应 |
8.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4L氩气含有原子数为2Na | |
| C. | 常温常压下,32g O2和O3混合气所含氧原子数是2NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
5.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)═CH3OH(g)△H,如表所列数据是该反应在不同温度下的化学平衡常数(K).
(1)根据表中数据可判断△H<0 (填“>”、“=”或“<”).
(2)在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断.
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)在300℃时,将2mol CO、3mol H2和2mol CH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断.
 有悖于“节能减排,和谐发展”这一主题的是( )
有悖于“节能减排,和谐发展”这一主题的是( )
 .
. .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: .
.