题目内容
12.已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.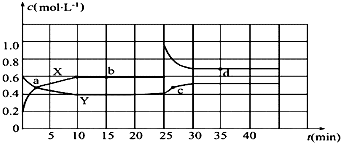
(1)图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d.
(2)①前10min内用NO2表示的化学反应速率v(NO2)=0.04mol•L-1•min-1.
②0~15min,反应2NO2(g)?N2O4(g)的平衡常数Kb=$\frac{10}{9}$.
③25min~35min时,反应2NO2(g)?N2O4(g)的平衡常数Kd=Kb(填“>”、“=”或“<”).
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是增大NO2的浓度(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是BD.
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4.
分析 (1)根据反应方程式2NO2(g)?N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此结合图象中物质浓度的变化量判断;
物质的浓度不发生变化时表示化学反应处于平衡状态,根据图象判断处于平衡状态的点;容器内混合气体的体积不变,质量不变所以密度不变;
(2)①根据v=$\frac{△c}{△t}$计算v(NO2);
②0~15min,根据图象求出平衡时的浓度,再根据K的表达式求出K;
③由曲线看出25 min时,NO2的浓度突然增大;温度不变,化学平衡常数不变;
(3)由曲线看出25 min时,NO2的浓度突然增大;根据压强对平衡的影响分析.
解答 解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,10-25min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态,
故答案为:X;b和d;
(2)①X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=$\frac{0.4mol/L}{10min}$=0.04mol•L-1•min-1,
故答案为:0.04;
②0~15min,反应2NO2(g)?N2O4(g),v(NO2)=0.6mol•L-1,v(N2O4)=0.4mol•L-1,则K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.4}{0.{6}^{2}}$=$\frac{10}{9}$,
故答案为:$\frac{10}{9}$;
③由曲线看出25 min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度;温度不变,化学平衡常数不变;
故答案为:=;
(3)因在25 min时,增大了NO2的浓度,相当于增大了压强,平衡右移,d点时NO2的百分含量小于b时NO2百分含量,要使25 min时改变条件达到使NO2(g)的百分含量与d点相同的化学平衡状态,可加压,加入一定量的N2O4,也相当于加压,
故答案为:增大NO2的浓度;BD.
点评 本题考查化学平衡的计算,涉及化学平衡图象、反应速率计算等知识,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学平衡常数、化学反应速率的概念及计算方法.

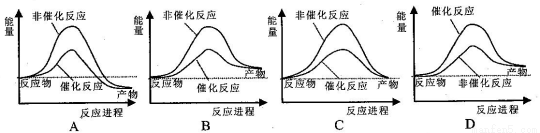
合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g) CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
| A. | 98g H2SO4 | B. | 6.02×1023个氮分子 | ||
| C. | 44.8L HCl | D. | 6g氢气 |
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
| A. | Fe | B. | Br | C. | Fe和Br | D. | Cl |

 某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.
某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.