题目内容
下列溶液中各微粒的浓度关系正确的是( )
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①>②>③ |
| B、pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
| C、0.2 mol?L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
考点:离子浓度大小的比较
专题:
分析:A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,NH4+浓度最小,NH4Cl和(NH4)2SO4水解程度相同,则c(NH4+)相同;
B.pH相等,说明OH-相等,即(Na+)-(F-)=(K+)-(CH3COO-)=OH-;
C.根据质子守恒可判断;
D.0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合,盐酸过量,生成氯化铝为弱电解质,部分电离,应存在c(Al3+)>c(H+).
B.pH相等,说明OH-相等,即(Na+)-(F-)=(K+)-(CH3COO-)=OH-;
C.根据质子守恒可判断;
D.0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合,盐酸过量,生成氯化铝为弱电解质,部分电离,应存在c(Al3+)>c(H+).
解答:
解:A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,NH4+浓度最小,NH4Cl和(NH4)2SO4水解程度相同,则c(NH4+)相同,正确顺序为①=②>③,故A错误;
B.pH相等,说明OH-相等,即(Na+)-(F-)=(K+)-(CH3COO-)=OH-,故B错误;
C.根据质子守恒,应该有c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合,盐酸过量,生成氯化铝为弱电解质,部分电离,应存在c(Al3+)>c(H+),正确顺序应为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D正确.
故选:D.
B.pH相等,说明OH-相等,即(Na+)-(F-)=(K+)-(CH3COO-)=OH-,故B错误;
C.根据质子守恒,应该有c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合,盐酸过量,生成氯化铝为弱电解质,部分电离,应存在c(Al3+)>c(H+),正确顺序应为c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D正确.
故选:D.
点评:本题考查离子浓度大小比较,明确溶质的性质确定溶液酸碱性,再结合守恒思想分析解答,注意离子之间的相互影响,题目难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、盐酸与澄清石灰水反应:H++OH-═H2O |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3- |
下列比较不正确的是( )
| A、等浓度的NH4HSO4、NH3?H2O、(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大 |
| B、NaClO和BaCl2混合溶液:c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-) |
| C、25℃下,0.2 mol?L-1 HCl溶液与0.2 mol?L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol?L-1 |
| D、常温下,将0.2 mol?L-1某一元碱ROH溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
日常生活中,下列做法中不会对人体健康造成危害的是( )
| A、腌制腊类物质添加大量亚硝酸钠 |
| B、金针菇可用福尔马林浸泡来达到保鲜的目的 |
| C、用NaHCO3发酵面包 |
| D、竹笋用二氧化硫气体漂白 |
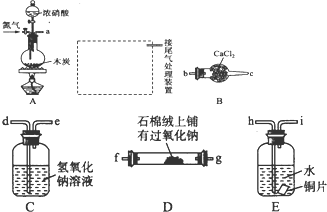
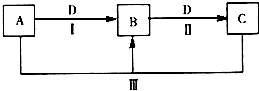 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).