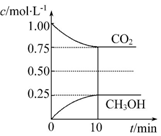
题目内容
10.无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如图,请回答下列问题: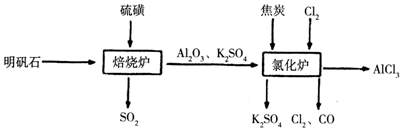
(1)实验室中,可制得C12的组合是①②③④(填代号).
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2)吸收焙烧炉中产生的尾气,下列装置合理的是ad(填代号).

(3)写出氧化炉中反应的化学方程式3C+Al2O3+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3.
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、C12等大气污染物,若将二者按照一定比例通入水中可减少污染.试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应(仪器自选).
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如图装置验证二氧化硫的某些化学性质.
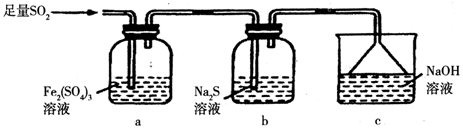
①能说明二氧化硫具有氧化性的实验现象为b中出现淡黄色沉淀.
②写出a瓶中发生反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验.
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色.
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去.
实验III:向第三份溶液中加入BaCl2溶液,生成白色沉淀.
上述实验中能充分证明二氧化硫具有还原性的是:Ⅰ和Ⅱ(填实验代号).
分析 本题是探究利用明矾石制备无水氯化铝的实验操作题,涉及利用SO2能使品红褪色来检验SO2、因SO2易溶解水因此吸收SO2时要设计防倒吸装置、利用氯化炉发生的氧化还原反应制备氯化铝,另外还设计实验探究了SO2的氧化性和还原性,据此分析解答,
(1)根据MnO2和浓盐酸混合共热和次氯酸根、氢离子、氯离子混合可以制得C12分析;
(2)根据装置能否防止溶液倒吸分析解答;
(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO,结合质量守恒定律写出此反应的化学方程式;
(4)二氧化硫溶液与氯水都可以使品红溶液褪色,据此设计实验;
(5)①b中硫化钠溶液里S2-具有还原性,遇SO2会有淡黄色的硫析出;
②二氧化硫能被硫酸铁溶液氧化,生成硫酸根离子和亚铁离子;
③实验Ⅰ中有氢氧化亚铁沉淀生成,实验Ⅱ中有亚铁离子生成,都说明二氧化硫将铁离子还成亚铁离子,说明二氧化硫具有还原性,
实验Ⅰ:亚铁离子与氢氧化钠生成氢氧化亚铁沉淀,氢氧化亚铁被空气氧化成氢氧化铁;
实验Ⅱ:亚铁离子与KMnO4(H2SO4酸化)溶液,发生氧化还原反应,高锰酸钾溶液褪色;
实验Ⅲ:硫酸根离子与氯化钡生成硫酸钡沉淀.
解答 解:(1)①MnO2和浓盐酸混合共热生成氯化锰、氯气和水,故正确;
②NaCl和浓硫酸混合共热能生成浓盐酸再与MnO2混合共热生成氯化锰、氯气和水,故正确;
③NaClO和盐酸混合共热,其中次氯酸根、氢离子、氯离子混合反应生成氯气和水,故正确;
④漂白粉和硫酸混合共热,其中次氯酸根、氢离子、氯离子混合反应生成氯气和水,故正确;
故选:①②③④;
(2)a.干燥管球形处容积较大,溶液倒吸后会于烧杯内的液体分离,由重力作用又回到烧杯内,可以防止倒吸,故a正确;
b.广口瓶中进气管长,出气管短,不能防止倒吸,应进气管短,故b错误;
c.导管直接伸入液面内,会发生倒吸危险,故c错误;
d.二氧化硫经过四氯化碳后,被氢氧化钠溶液吸收,可以防止倒吸,故d正确,
故选:ad;
(3)由流程图可知,氯化炉中氧化铝、碳、氯气反应生成氯化铝、CO,反应方程式为:3C+Al2O3+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3,故答案为:3C+Al2O3+3Cl2$\frac{\underline{\;高温\;}}{\;}$3CO+2AlCl3;
(4)取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应,
故答案为:取二者溶于水后的溶液少许置于试管中,向其中加入品红溶液,若品红不褪色,说明二者恰好完全反应,否则,两者未完全反应;
(5)①硫化钠溶液里通SO2发生反应的离子方程式为SO2+2S2-+2H2O=3S↓+4OH-,此反应体现了SO2的氧化性,看到的现象是b中出现淡黄色沉淀,故答案为:b中出现淡黄色沉淀;
②二氧化硫能被硫酸铁溶液氧化,生成硫酸根离子和亚铁离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
③实验Ⅰ中有氢氧化亚铁沉淀生成,实验Ⅱ中有亚铁离子生成,都说明二氧化硫将铁离子还成亚铁离子,说明二氧化硫具有还原性,所以实验Ⅰ和Ⅱ都说明二氧化硫具有还原性,故答案为:Ⅰ和Ⅱ.
点评 本题考查化学与技术、实验制备方案设计等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 其他条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度可提高SO2的转化率 | |
| D. | 平衡时,其他条件不变,分离出硫,正反应速率加快 |
| A. | 甲烷与氧气反应 | B. | 碳酸钙分解反应 | C. | KOH与稀硫酸反应 | D. | 铁丝与氯气反应 |
| A. | 2mol•L-1 | B. | 3 mol•L-1 | C. | 1mol•L-1 | D. | 0.5 mol•L-1 |
| 选项 | 离子或分子 | 要 求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Fe3+、Na+、NO3-、ClO- | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| D | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2.4 g镁在足量的O2中燃烧,转移的电子数为0.1 NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2 NA | |
| C. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| D. | 常温常压下,8 g O3中含有8 NA个电子 |
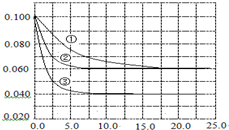 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1,c(B)=0.200mol•L-1,c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应A+2B?C的△H>0 | |
| B. | 若反应①、②的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 实验②平衡时B的转化率为60% | |
| D. | 减小反应③的压强,可以使平衡时c(A)=0.060 mol•L-1 |