题目内容
20.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l)△H<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 其他条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度可提高SO2的转化率 | |
| D. | 平衡时,其他条件不变,分离出硫,正反应速率加快 |
分析 A.由于该反应的正反应是气体体积减小的反应,随着反应的进行,气体的物质的量逐渐减小;
B.催化剂能够相同倍数的改变正反应、逆反应的速率,不能使化学平衡发生移动;
C.该反应的正反应是放热反应,升高温度,根据平衡移动原理,平衡向吸热的逆反应方向移动;
D.硫是固体物质,物质的浓度不变,根据浓度对速率的影响判断.
解答 解:A.由于该反应的正反应是气体体积减小的反应,所以平衡前,随着反应的进行,气体的物质的量逐渐减小,因此容器内压强逐渐减小,故A错误;
B.由于催化剂能够相同倍数的改变正反应、逆反应的速率,所以不能使化学平衡发生移动.其他条件不变,使用不同催化剂,该反应的平衡常数不变,故B正确;
C.该反应的正反应是放热反应,平衡时,其他条件不变,升高温度,根据平衡移动原理,平衡向吸热的逆反应方向移动,所以SO2的转化率降低,故C错误;
D.平衡时,其他条件不变,分离出硫,由于硫是固体物质,物质的浓度不变,所以正反应速率不变,故D错误.
故选B.
点评 本题考查外界条件对化学反应速率、化学平衡移动、物质的平衡转化率的影响的知识.

练习册系列答案
相关题目
17.如图是可逆反应 2Y2?Z2 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )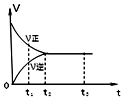

| A. | t1时,只有正方向反应 | |
| B. | t2-t3,反应不再发生 | |
| C. | t2-t3,各物质的浓度均没有发生变化 | |
| D. | t2时,反应到达限度,正反应和逆反应速率相等且等于零 |
11.已知20℃时,磷酸与氢氧化钙生成的三种盐的溶解度(每升饱和溶液中含溶质的质量)如表所示:
下列叙述正确的是( )
| 物质 | Ca3(PO4)2 | CaHPO4 | Ca(H2PO4)2 |
| 溶解度(g•L-1) | 2×10-2 | 4.303×10-2 | 18 |
| A. | 含Ca(H2PO4)2的磷肥可以与草木灰混施 | |
| B. | Ksp[CaHPO4]=c(Ca2+)•c(H+)•c(PO43-) | |
| C. | 20℃时,Ca(H2PO4)2饱和溶液物质的量浓度为0.13 mol•L-1 | |
| D. | 向澄清石灰水中逐滴滴入稀磷酸,开始出现浑浊,后变澄清 |
15.工业上用DME法以H2和CO为原料生产甲醚(CH3OCH3).其原理是在同一容器中发生如下两个连续反应:
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
①2H2(g)+CO(g)═CH3OH(g)
②2CH3OH(g)═CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是( )
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
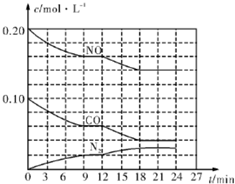 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.热化学反应方程式为 2N0(g)+2C0(g)?N2 (g)+2C02 (g)△H=-746.5kJ•mol-1,将1.0mol N0和1.0mol C0充入一个容积为10L的密闭容器中,反应过程中物质浓度变化如图所示. 甲醇是一种重要的可再生能源.
甲醇是一种重要的可再生能源.