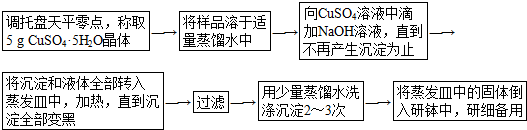
题目内容
19.下列溶液或浊液中,关于离子浓度的说法正确的是( )| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
分析 A.氨水稀释后电离程度增大,则铵根离子的物质的量增大,一水合氨的物质的量减小;
B.碳酸根离子的水解程度大于碳酸氢根离子,结合混合液中的物料守恒判断;
C.醋酸的浓度不同,电离程度不同;
D.氯化银和Ag2Cr2O4的类型不同,不能直接根据其溶度积判断其溶解度大小.
解答 解:A.加水稀释时,促进一水合氨电离,铵根离子的物质的量增大,一水合氨的物质的量减小,所以c(NH4+):c(NH3•H2O)比值增大,故A错误;
B.等浓度的碳酸钠、碳酸氢钠溶液中,碳酸根离子的水解程度较大,则c(CO32-)<c(HCO3-),根据物料守恒可得:2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-),故B正确;
C.醋酸为弱酸,醋酸的浓度不同时其电离程度不同,则pH=1与pH=2的CH3COOH)溶液中c(H+)浓度之比≠1:10,故C错误;
D.由于AgCl和Ag2Cr2O4的类型不同,则不能直接根据难溶物溶度积判断溶解度大小,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及弱电解质的电离、难溶物溶度积的应用、离子浓度大小比较等知识,明确弱电解质的电离平衡及其影响为解答关键,注意掌握物料守恒、电荷守恒的含义及应用方法.

练习册系列答案
相关题目
9.分子式为C8H8O2并能与饱和NaHCO3溶液反应放出气体的芳香族化合物有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
10.下列关于分散系的叙述不正确的是( )
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | 下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关 |
7.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
4.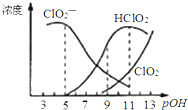 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
11.将过量的CO2分别通入:①CaCl2溶液 ②NaAlO2溶液 ③Ca(OH)2溶液 ④饱和Na2CO3溶液.最终溶液中有白色沉淀析出的是( )
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |
8.FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
| A. | 滴加盐酸时,先产生沉淀又溶解 | |
| B. | 都能透过半透膜 | |
| C. | 加热、蒸干、灼烧,最终都有Fe2O3生成 | |
| D. | 都有丁达尔效应 |
9.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(2)写出E溶液与过量的B溶液反应的离子方程式2Al3++3SO42-+3Ba2++8OH-=2AlO2-+3BaSO4↓+4H2O.
(3)已知:NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l);△H=-a kJ•mol-1.请写出B与C的稀溶液反应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-akJ/mol.
(4)在100 mL 0.1 mol•L-1E溶液中,逐滴加入35 mL 2 mol•L-1NaOH溶液,最终得到沉淀的物质的量为0.01mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(2)写出E溶液与过量的B溶液反应的离子方程式2Al3++3SO42-+3Ba2++8OH-=2AlO2-+3BaSO4↓+4H2O.
(3)已知:NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l);△H=-a kJ•mol-1.请写出B与C的稀溶液反应的热化学方程式OH-(aq)+H+(aq)=H2O(1)△H=-akJ/mol.
(4)在100 mL 0.1 mol•L-1E溶液中,逐滴加入35 mL 2 mol•L-1NaOH溶液,最终得到沉淀的物质的量为0.01mol.