题目内容
4.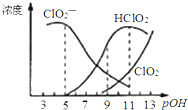 亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( )| A. | HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 亚氯酸钠在碱性条件下较稳定 | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c( ClO2)>c( Cl-) | |
| D. | 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) |
分析 A、HClO2的电离平衡常数K=$\frac{c(Cl{{O}_{2}}^{-})•c({H}^{+})}{c(HCl{O}_{2})}$结合图示数据来计算;
B、由图可以得出:碱性条件下ClO2-浓度高;
C、根据图知,pH=7时,c(HClO2)<c( ClO2-);
D、依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-)+c( Cl-),依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2)+c( Cl-),据此解答即可.
解答 解:A、HClO2的电离平衡常数K=$\frac{c(Cl{{O}_{2}}^{-})•c({H}^{+})}{c(HCl{O}_{2})}$,观察图象可以看出,当pOH=8时,pH=6,c(ClO2-)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=10-6,故A正确;
B、由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故B正确;
C、根据图知,pH=7时,存在c(HClO2)<c( ClO2-),则微粒浓度大小顺序是c( ClO2-)>c(HClO2)>c( ClO2)>c( Cl-),故C错误;
D、依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c( Cl-)+c(OH-) ①,依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2)+c( Cl-) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)+c( Cl-),故D错误;
故选CD.
点评 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.

练习册系列答案
相关题目
14.根据下列有关图象,说法正确的是( )
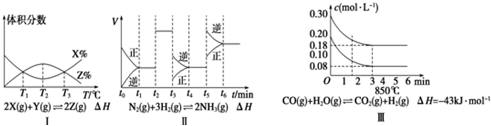

| A. | 由图I知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图II知,反应在t1时,NH3体积分数最大 | |
| C. | 由图II知,t3时采取的措施是降低反应体系温度 | |
| D. | III在10 L容器、850℃时反应,由图知,到4 min时,反应放出5.16 kJ的热量 |
12.取物质的量浓度相等的CuCl2、FeCl3的混合溶液40mL平分于两只试管,向其中一只试管加入足量AgNO3溶液生成14.35g 沉淀,向另一只试管加入1.12g 还原铁粉充分反应后该试管溶液中存在的金属阳离子及其物质的量浓度是( )
| A. | Fe2+ 2mol/L、Cu2+ 0.5mol/L | B. | Fe2+ 1mol/L、Fe3+ 1mol/L | ||
| C. | Fe2+ 0.5mol/L、Cu2+ 0.25mol/L | D. | Fe2+ 1.5mol/L、Cu2+ 0.5mol/L |
19.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
9.下列说法正确的是( )
| A. | 漂白粉的主要成分是次氯酸钙 | |
| B. | 碘化银不能用于人工降雨 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 碘盐中的碘可以直接用淀粉溶液检验 |
16.下列溶液不能用带磨口玻璃塞的试剂瓶保存的是( )
| A. | 稀硫酸 | B. | NaOH | C. | 氢氟酸 | D. | 浓盐酸 |
13. 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③在方框内画出[QZ4]2-的空间构型(用虚线表示空间构型的轮廓)并表示出中心离子与配原子之间的化学键.
 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
(1)写出与Y2互为等电子体的分子式CO.
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是NH3分子间能形成氢键,而HCl分子间没有氢键.
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是N>C>Na.
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2.
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是sp;sp3.
③在方框内画出[QZ4]2-的空间构型(用虚线表示空间构型的轮廓)并表示出中心离子与配原子之间的化学键.
14.下列有关说法错误的是( )
| A. | 钠在空气中充分燃烧时先熔化再燃烧,最后所得的产物只有Na2O2 | |
| B. | 金属钠不能保存在密闭容器中,应保存在煤油中 | |
| C. | 铝制品在生活中非常普遍,是因为铝的化学性质不活泼 | |
| D. | 铁在潮湿的空气中形成的氧化物疏松,不能保护内层金属,故铁制品往往需涂保护层 |