题目内容
9.分子式为C8H8O2并能与饱和NaHCO3溶液反应放出气体的芳香族化合物有(不考虑立体异构)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
分析 分子式为C8H8O2的有机物能与NaHCO3发生反应产生CO2,说明含有羧基-COOH,芳香族化合物一定含有苯环,据此判断该有机物可能含有的官能团及结构.
解答 解:芳香化合物中一定含有苯环,该有机物能与饱和NaHCO3溶液反应放出气体,则其分子中含有羧基,1个苯环和羧基的不饱和度为:4+1=5,而C8H8O2的不饱和度为:$\frac{8×2+2-8}{2}$=5,说明该有机物分子中不含其它不饱和结构,
苯环中含有6个碳原子,羧基中含有1个C原子,则该苯环侧链可能组成有:①1个-CH2COOH,形成有机物为苯乙酸;
②1个-CH3和1个-COOH,存在邻、间、对三种结构,
所以满足条件的有机物总共有4种,
故选A.
点评 本题考查了有机物结构与性质的应用,题目难度不大,明确常见有机物官能团及具有性质为解答关键,注意掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
7. 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
 在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )
在常温下,用0.1000mol/L的盐酸滴定25mL 0.1000mol/L Na2CO3溶液,所得滴定曲线如图所示.下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是( )| A. | a点:c( HCO3-)>c(Cl-)>c(CO32-) | |
| B. | b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH -) | |
| C. | c点:c(OH -)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | d点:c(Cl-)=c(Na+) |
8.下列各组中的物质,能在溶液中大量共存的是( )
| A. | KNO3 NaCl NaOH | B. | KOH Na2CO3 HCl | ||
| C. | KNO3 NaOH FeCl3 | D. | AgNO3 BaCl2 HNO3 |
17.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的非金属性强弱顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W和Z形成的物质中只含离子键 | |
| D. | 由Y形成的氢化物中可能是H2Y或YH3、YH4 |
4.物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
| A. | HX、HY、HZ | B. | HX、HZ、HY | C. | HZ、HY、HX | D. | HY、HZ、HX |
14.根据下列有关图象,说法正确的是( )
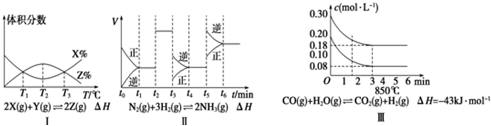

| A. | 由图I知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图II知,反应在t1时,NH3体积分数最大 | |
| C. | 由图II知,t3时采取的措施是降低反应体系温度 | |
| D. | III在10 L容器、850℃时反应,由图知,到4 min时,反应放出5.16 kJ的热量 |
1.下列离子方程式书写正确的是( )
| A. | 盐酸与Na2SiO3溶液混合:SiO32-+2H+═H2SiO3 | |
| B. | Cl2和H2O反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | NO2通入水中:H2O+3NO2═2H++2NO3-+NO | |
| D. | 浓盐酸和二氧化锰共热制Cl2:MnO2+4H++2Cl-═Mn2++Cl2+2H2O |
18.聚合氯化铝(PAC)是常用于水质净化的无机高分子混凝剂,其化学式可表示为[Al2(OH)nCl6-n]m(n<6,m为聚合度).PAC常用高温活化后的高岭土(主要化学组成为Al2O3、SiO2、Fe2O3)进行制备,工艺流程如图1所示:
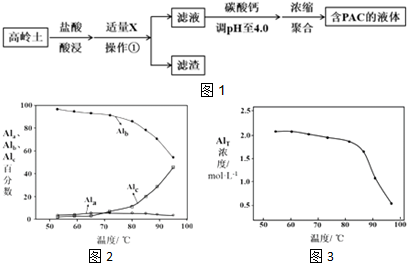
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.

(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.
19.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |