题目内容
7.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
分析 强碱溶液中含大量的氢氧根离子,酸溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.碱溶液中不能大量存在NH4+、Cu2+,酸溶液中该组离子之间不反应可共存,故A不选;
B.酸溶液中Fe2+、H+、NO3-发生氧化还原反应不能共存,碱溶液中不能大量存在Fe2+,故B选;
C.酸溶液中不能大量存在CO32-,碱溶液中不反应可大量共存,故C不选;
D.酸溶液中不能大量存在S2-,碱溶液中该组离子之间不反应可共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
17.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | W、Y、Z的非金属性强弱顺序一定是Z>Y>W | |
| B. | W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z | |
| C. | W和Z形成的物质中只含离子键 | |
| D. | 由Y形成的氢化物中可能是H2Y或YH3、YH4 |
18.聚合氯化铝(PAC)是常用于水质净化的无机高分子混凝剂,其化学式可表示为[Al2(OH)nCl6-n]m(n<6,m为聚合度).PAC常用高温活化后的高岭土(主要化学组成为Al2O3、SiO2、Fe2O3)进行制备,工艺流程如图1所示:
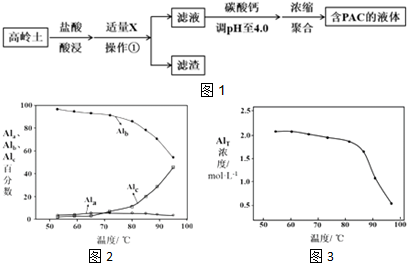
(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.

(1)盐酸酸浸所涉及反应的离子方程式是6H++Al2O3═2Al3++3H2O、6H++Fe2O3═2Fe3++3H2O.
(2)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
根据表中数据解释加入X的主要目的:调节溶液pH至Fe3+完全沉淀,滤渣中主要含有物质的化学式是Fe(OH)3、SiO2.
(3)已知:生成液体PAC的反应为2Al3++m(6-n) Cl-+mn H2O?[Al2(OH)nCl6-n]m+mn H+.用碳酸钙调节溶液的pH时,要严控pH的大小,pH偏小或偏大液体PAC的产率都会降低.请解释pH偏小液体PAC产率降低的原因:pH偏小时,抑制平衡2Al3++m(6-n)Cl-+mnH2O?[Al2(OH)nCl6-n]m+mnH+正向移动生成PAC.
(4)浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
Ala--Al3+单体形态铝
Alb--[Al2(OH)nCl6-n]m聚合形态铝
Alc--Al(OH)3胶体形态
图2为Al各形态百分数随温度变化的曲线;图3为含PAC的液体中铝的总浓度AlT随温度变化的曲线.
①50-90℃之间制备的液体PAC中,聚合形态铝含量最多.
②当T>80℃时,AlT明显降低的原因是温度升高,导致液体PAC向Al(OH)3沉淀转化.
2.下列选用的除杂试剂和实验操作都正确的(已知2Br-+Cl2═Br2+2Cl-)是( )
| 选项 | 物质 | 杂质 | 除杂试剂 | 操作方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙 | 过滤 |
| B | NaCl溶液 | NaBr | 稍过量氯水、乙醇 | 萃取、分液 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液 | 过滤 |
| D | O2 | CO | 氧化铜 | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
12.取物质的量浓度相等的CuCl2、FeCl3的混合溶液40mL平分于两只试管,向其中一只试管加入足量AgNO3溶液生成14.35g 沉淀,向另一只试管加入1.12g 还原铁粉充分反应后该试管溶液中存在的金属阳离子及其物质的量浓度是( )
| A. | Fe2+ 2mol/L、Cu2+ 0.5mol/L | B. | Fe2+ 1mol/L、Fe3+ 1mol/L | ||
| C. | Fe2+ 0.5mol/L、Cu2+ 0.25mol/L | D. | Fe2+ 1.5mol/L、Cu2+ 0.5mol/L |
19.下列溶液或浊液中,关于离子浓度的说法正确的是( )
| A. | 一定浓度的氨水加水稀释的过程中,c(NH4+)/c(NH3•H2O)的比值减小 | |
| B. | 浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液中:c(CO32-)<c(HCO3-),且2c(Na+)═3c(H2CO3)+3c(HCO3-)+3c(CO32-) | |
| C. | pH=1与pH=2的CH3COOH)溶液中,c(H+)浓度之比为1:10 | |
| D. | 常温下,已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+) |
16.下列溶液不能用带磨口玻璃塞的试剂瓶保存的是( )
| A. | 稀硫酸 | B. | NaOH | C. | 氢氟酸 | D. | 浓盐酸 |
17.下列说法错误的是( )
| A. | 铅笔芯的主要原料是石墨,儿童使用时不会引起中毒 | |
| B. | CO有毒,生有煤炉的居室可放置数盆清水,能有效地吸收CO,防止煤气中毒 | |
| C. | “汽水”浇灌植物有一定的道理,其中CO2的释放,有利于植物的光合作用 | |
| D. | 硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂” |