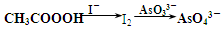题目内容
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 27g Al3+所含电子数为NA | |
| B. | 11.2L氯气所含的原子数目为NA | |
| C. | 常温常压下32g氧气所含的原子数目为2NA | |
| D. | 标准状况下,22.4 L水中含有的水分子数为NA |
分析 A.铝离子含有10个电子,27g铝离子的物质的量为1mol,含有10mol电子;
B.没有指出在标准状况下,无法计算氯气的物质的量;
C.根据n=$\frac{m}{M}$计算出氧气的物质的量,然后可得出含有氧原子的物质的量及数目;
D.标准状况下,水的状态不是气态.
解答 解:A.27g Al3+的物质的量为1mol,1mol铝离子含有10mol电子,含有电子数为10NA,故A错误;
B.不是标准状况下,不能根据标准状况下的气体摩尔体积计算,故B错误;
C.32g氧气的物质的量为1mol,1mol氧气含有2molO原子,所含的原子数目为2NA,故C正确;
D.标况下水不是气体,不能使用标况下的气体摩尔体积计算,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的计算,题目难度不大,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与其他物理量之间的关系,试题有利于提高学生的化学计算能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
12.下列说法中正确的是( )
| A. | l mol任何气体的体积都约是22.4L | |
| B. | l mol任何物质在标准状况下所占体积都约是22.4L | |
| C. | 不同的气体,体积相同,它们所含的分子数可能不同 | |
| D. | 在同温同压下,相同质量的氯气和氢气体积相同 |
13.在CuSO4、Fe2(SO4)3和ZnSO4混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生.则下列结论正确的是( )
| A. | 滤液中一定有Fe2(SO4)3和FeSO4 | |
| B. | 滤液中可能有CuSO4,一定有FeSO4、ZnSO4 | |
| C. | 滤渣中一定有Cu和Fe,一定无Zn | |
| D. | 滤渣中可能有Cu、Fe和Zn |
7.下列物质不能通过化合反应制得的是( )
| A. | MgCl2 | B. | Fe(OH)3 | C. | SO3 | D. | Al(OH)3 |
11.固体单质X和气体Y在容积一定的密闭容器中完全反应生成气体Z,相同温度下测得容器内压强不变,若产物气体Z的密度是原气体密度的3倍,则判断正确的是( )
| A. | 反应前后的气体质量之比一定是1:3 | |
| B. | 两种单质X、Y的摩尔质量之比是1:3 | |
| C. | 在生成物Z中,X的质量分数为50% | |
| D. | Z中X、Y两元素的原子个数比为3:1 |
15.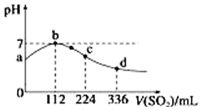 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A. | b点水的电离程度比c点水的电离程度大 | |
| B. | 氢硫酸的酸性比亚硫酸的酸性强 | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | a点对应溶液的导电性比d点强 |
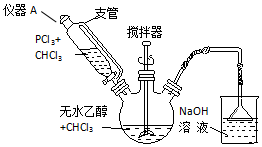
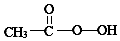 )常用作纺织品漂白剂.
)常用作纺织品漂白剂.