题目内容
10.钢铁的生产和使用是人类文明和生活进步的一个重要标志.(1)金属制品中的镀锡铁皮(马口铁)和镀锌铁皮(白铁皮)镀层部分破坏后,在潮湿的环境中,马口铁(填“马口铁”或“白铁皮”)更易锈蚀.
(2)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.
铁锅所发生的腐蚀主要是吸氧腐蚀,铁锅锈蚀的负极反应式为Fe-2e-=Fe2+.
(3)为防止轮船的船体在海水中腐蚀,一般在轮船身上装有一定数量的锌(填“锌”或“铜”)块.
分析 (1)金属活泼性Zn>Fe>Sn,活泼金属作负极,失去电子易腐蚀;
(2)Fe、C和NaCl溶液构成原电池,将化学能转化为电能;Fe易失电子作负极、C作正极,正极上氧气得电子发生还原反应;
(3)金属活泼性Zn>Fe>Cu,活泼金属作负极,Fe作正极时可防止轮船的船体在海水中腐蚀.
解答 解:(1)金属活泼性Zn>Fe>Sn,则Fe作负极时失去电子更易腐蚀,则在潮湿的环境中,部分破损后的马口铁更易腐蚀,
故答案为:马口铁;
(2)Fe、C和NaCl溶液构成原电池,将化学能转化为电能,所以铁发生电化学腐蚀,负极铁失电子生成亚铁离子,电极反应式为 Fe-2e-=Fe2+,正极是氧气得到电子生成氢氧根离子,是吸氧腐蚀,故答案为:吸氧; Fe-2e-=Fe2+;
(3)金属活泼性Zn>Fe>Cu,活泼金属作负极,Fe作正极时可防止轮船的船体在海水中腐蚀,则防止轮船的船体在海水中腐蚀,一般在轮船的船身上装有一定数量的锌块,故答案为:锌.
点评 本题考查电化学腐蚀的应用、原电池反应原理和电极反应等知识点,为高频考点,把握原电池的工作原理、牺牲阳极的阴极保护法应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.有关溴乙烷的下列叙述中,正确的是( )
| A. | 溴乙烷不溶于水,能溶于大多数有机溶剂 | |
| B. | 溴乙烷与NaOH的醇溶液共热可生成乙醇 | |
| C. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
1.已知A是一种金属单质,B为淡黄色固体,其转化关系如图所示,则以下有关C的性质描述错误的是( )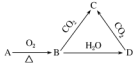

| A. | C与CO2能继续反应 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与足量盐酸反应放出气体 | D. | 受热易分解 |
5.硅是带来人类文明的重要元素之一.下列物质中主要成分是硅酸盐的是( )
| A. | 玻璃 | B. | 金刚石 | C. | 水晶 | D. | 大理石 |
15.在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t∕min | 2 | 4 | 7 | 9 |
| n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前4min的平均反应速率υ(Z)=0.0125 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大 |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 27g Al3+所含电子数为NA | |
| B. | 11.2L氯气所含的原子数目为NA | |
| C. | 常温常压下32g氧气所含的原子数目为2NA | |
| D. | 标准状况下,22.4 L水中含有的水分子数为NA |
3.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
| A. | 加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl- | |
| B. | 新制氯水使红玫瑰变为白玫瑰,说明有Cl2 | |
| C. | 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO | |
| D. | 光照新制氯水有气泡逸出,该气体一定是Cl2 |