题目内容
13.在CuSO4、Fe2(SO4)3和ZnSO4混合溶液中,加入一定量的铁粉,充分反应后过滤,在滤渣中加入稀盐酸,有气体产生.则下列结论正确的是( )| A. | 滤液中一定有Fe2(SO4)3和FeSO4 | |
| B. | 滤液中可能有CuSO4,一定有FeSO4、ZnSO4 | |
| C. | 滤渣中一定有Cu和Fe,一定无Zn | |
| D. | 滤渣中可能有Cu、Fe和Zn |
分析 向含有CuSO4、Fe2(SO4)3和ZnSO4的混合溶液中加入一定量的铁粉,铁粉先和Fe2(SO4)3溶液反应生成硫酸亚铁,反应完后再和硫酸铜溶液反应生成铜和硫酸亚铁,铁粉不和硫酸锌溶液反应,所以使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,说明一定金属铁有剩余,故滤液中一定含Fe2+、Zn2+,不含Cu2+、Fe3+,由此分析解答.
解答 解:向含有CuSO4、Fe2(SO4)3和ZnSO4的混合溶液中加入一定量的铁粉,铁粉先和Fe2(SO4)3溶液反应生成硫酸亚铁,反应完后再和硫酸铜溶液反应生成铜和硫酸亚铁,铁粉不和硫酸锌溶液反应,所以使其充分反应后,过滤,向滤渣中滴加稀盐酸,有气泡产生,说明一定金属铁有剩余,故滤液中一定含Fe2+、Zn2+,不含Cu2+、Fe3+,
A、滤液中一定没有Fe2(SO4)3,故A错误;
B、滤液中不可能有CuSO4,故B错误;
C、滤渣中一定有Cu和Fe,一定无Zn,故C正确;
D、滤渣中不可能有Zn,故D错误;
故选:C.
点评 本题主要考查了对金属活动性顺序的灵活应用,只有活动性强的金属可以把活动性弱的金属从盐溶液中置换出来,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目
3.下列叙述中,指定粒子的数目约为6.02×1023的是( )
| A. | 1.6gCH4中含有的分子数 | |
| B. | 1molH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下22.4LCO气体中含有的分子数 |
4.在一定条件下,KClO3与I2发生下列反应:2KClO3+I2=2KIO3+Cl2推断正确的是( )
| A. | 该反应属于置换反应 | B. | 氧化性I2>KClO3 | ||
| C. | 还原性KClO3>I2 | D. | 还原剂为I2,氧化剂为Cl2 |
1.已知A是一种金属单质,B为淡黄色固体,其转化关系如图所示,则以下有关C的性质描述错误的是( )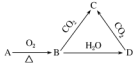

| A. | C与CO2能继续反应 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与足量盐酸反应放出气体 | D. | 受热易分解 |
8.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OH-═Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-3e-═Fe3+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解500mL硝酸银溶液,当消耗铜电极32 g时,电解池溶液中pH=2 |
5.硅是带来人类文明的重要元素之一.下列物质中主要成分是硅酸盐的是( )
| A. | 玻璃 | B. | 金刚石 | C. | 水晶 | D. | 大理石 |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 27g Al3+所含电子数为NA | |
| B. | 11.2L氯气所含的原子数目为NA | |
| C. | 常温常压下32g氧气所含的原子数目为2NA | |
| D. | 标准状况下,22.4 L水中含有的水分子数为NA |
6.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A. | C3H8(l)+5O2(g)═3CO2(g)+4H2O(l)△H=-2219.9 kJ/mol | |
| B. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol |