题目内容
15.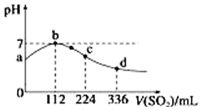 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A. | b点水的电离程度比c点水的电离程度大 | |
| B. | 氢硫酸的酸性比亚硫酸的酸性强 | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | a点对应溶液的导电性比d点强 |
分析 A.依据反应2H2S+SO2=3S↓+2H2O可算出n(H2S),进而计算c(H2S);
B.d点时,亚硫酸浓度约是0.1mol/L,酸性比同浓度硫化氢强,H2S的酸性比H2SO3弱;
C.b点溶液为中性,水的电离不受影响,而c点溶液显酸性,水的电离受到抑制;
D.H2S和H2SO3均为二元酸,结合a、d点溶液酸性强弱比较.
解答 解:A.b点溶液为中性,水的电离不受影响,而c点溶液显酸性,水的电离受到抑制,b点水的电离程度比c点水的电离程度大,故A正确;
B.d点时,亚硫酸浓度约是0.1mol/L,酸性比同浓度硫化氢强,H2S的酸性比H2SO3弱,故B错误;
C.b点时H2S恰好反应,消耗SO2为$\frac{0.112L}{22.4L/mol}$=0.005mol,由反应2H2S+SO2=3S↓+2H2O可知,n(H2S)=0.005mol×2=0.01mol,则c(H2S)=$\frac{0.01mol}{0.1L}$=0.1mol/L,故C错误;
D.H2S和H2SO3均为二元酸且d点溶液酸性比a点强,故d点溶液导电性强,故D错误;
故选A.
点评 本题考查化学反应图象、化学方程式有关计算、水的电离、溶液酸碱性、电解质溶液导电能力,注意B选项中应根据溶液物质的浓度相等时pH大小进行判断,学生容易根据已有知识回答,为解答易错点,题目难度中等.

练习册系列答案
相关题目
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 27g Al3+所含电子数为NA | |
| B. | 11.2L氯气所含的原子数目为NA | |
| C. | 常温常压下32g氧气所含的原子数目为2NA | |
| D. | 标准状况下,22.4 L水中含有的水分子数为NA |
6.下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
| A. | C3H8(l)+5O2(g)═3CO2(g)+4H2O(l)△H=-2219.9 kJ/mol | |
| B. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol |
3.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
| A. | 加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl- | |
| B. | 新制氯水使红玫瑰变为白玫瑰,说明有Cl2 | |
| C. | 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO | |
| D. | 光照新制氯水有气泡逸出,该气体一定是Cl2 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3分子数为0.1 NA | |
| B. | 标准状况下,2.24 L的CCl4中含有的C-Cl键数为0.4 NA | |
| C. | 常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| D. | 常温常压下,Na2O2与足量CO2反应生成2.24 L O2,转移电子数为0.2 NA |
7.某原电池装置如图所示.下列有关叙述中,正确的是( )
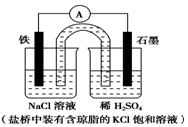

| A. | 电池工作中,盐桥的中Cl-向负极移动 | |
| B. | 负极反应:2H++2e-═H2↑ | |
| C. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| D. | Fe作正极,发生氧化反应 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L N2和H2混合气体中含N个原子 | |
| B. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| C. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1N | |
| D. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2N |
5.在某温度下,一密闭容器中模拟工业合成氨:N2(g)+3H2(g)?2NH3(g)△H<0;反应起始各物质的量如表:
达到平衡之后的 H2转化率α,NH3的体积分数为x%,下列说法错误的是( )
| N2 | H2 | NH3 | |
| 起始物质的量(mol) | 2 | 2 | 0 |
| A. | 平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol | |
| B. | 平衡时,N2的转化率为$\frac{α}{3}$ | |
| C. | 现将容器体积压缩到原来的一半,再次到达平衡之后,N2的体积分数变小 | |
| D. | 其他条件不变,若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,则到达平衡时,NH3的体积分数为x% |