题目内容
4.钠和铝是两种重要的金属.请回答:(1)将一小块金属钠投入水中,可观察到的实验现象是钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,
发生反应的化学方程式是2Na+2H2O=2NaOH+H2↑,并用单线桥标出电子转移的方向和数目
 ;
;(2)加热铝箔,其表面失去光泽,熔化后并不滴落,其原因是氧化膜熔点高,加热时氧化膜包裹着的内层熔化的铝而不会滴落.
(3)将铝箔放入氢氧化钠溶液中,反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是b(填字母)
a.1.12L b.>1.12L c.<1.12L.
分析 (1)钠与水发生2Na+2H2O=2NaOH+H2↑,钠的密度比水小,熔点低,能和水剧烈反应生成氢气,以此可判断反应现象;金属钠和水之间反应生成氢氧化钠和氢气,化合价升高元素Na的原子失电子,此元素在产物NaOH是氧化产物,化合价降低H元素的原子得电子,所在反应物氢气是氧化剂,得电子数=失电子数=转移电子数,电子转移如下: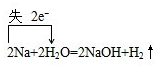 ;
;
(2)加热铝箔,先熔化,且生成的氧化铝包裹在熔化的Al的外面,使Al不滴落;
(3)Al、Al2O3与NaOH反应均生成NaAlO2;
(4)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据Na和氢气之间的关系式计算.
解答 解:(1)钠与水发生2Na+2H2O=2NaOH+H2↑,现象:钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声;金属钠和水之间反应生成氢氧化钠和氢气,化合价升高元素Na的原子失电子,此元素在产物NaOH是氧化产物,化合价降低H元素的原子得电子,所在反应物氢气是氧化剂,得电子数=失电子数=转移电子数,电子转移如下: ,
,
故答案为:钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声;2Na+2H2O=2NaOH+H2↑; ;
;
(2)氧化铝的熔点比铝的熔点高,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,
故答案为:氧化膜熔点高,加热时氧化膜包裹着的内层熔化的铝而不会滴落;
(3)铝性质活泼,易被氧化成氧化铝,氧化铝和碱反应为:Al2O3+2NaOH=2NaAlO2+H2O,离子反应为:Al2O3+2OH-=2AlO2-+H2O,铝与NaOH溶液反应生成偏铝酸钠和氢气,化学反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)Na和水反应生成NaOH和H2,NaOH和Al反应生成H2和NaAlO2,其方程式为Na+Al+2H2O=NaAlO2+2H2↑,根据方程式知,0.1molNa完全反应生成V(H2)=2n(Na).Vm=2×0.1mol×22.4L/mol=4.48L>1.12L,
故选b.
点评 本题以金属钠和水的反应为载体,涉及氧化还原反应、化学键、电子转移等知识的考查,注意知识的归纳和梳理是关键,难度中等.

②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
若标准状况下2.24L的H2恰好与足量O2反应生成H2O(l),则整个过程放出的热量为( )
| A. | 28.58kJ | B. | 24.18kJ | C. | 57.16kJ | D. | 48.36kJ |
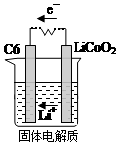 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
| A. | 在0.1mol/L的NaHSO4溶液中,含阳离子总数为0.2NA | |
| B. | 由2gH2、88gCO2、36gH2O组成的混合气体,密度约是相同状况下O2密度的0.79倍 | |
| C. | 1molAl与足量Na0H溶液反应生成H2的体积为33.6L | |
| D. | 56gFe单质与足量S单质在加热条件下充分反应,转移电子数为3NA |
| A. | 硅酸钠溶液 | B. | 氯化钙溶液 | C. | 氢氧化钙溶液 | D. | 碳酸钠饱和溶液 |
| A. | 6.2 g Na2O所含的离子数为0.2 NA | |
| B. | 46 gNO2与N2O4的混合气体中所含的原子数是3NA | |
| C. | 2.8 gN2中含有共用电子对的数目为0.1 NA | |
| D. | 0.1 molH2与Cl2的混合气体充分反应后,体系中含有共价键总数为0.2NA |
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 ,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
由此可以推断:
溶液中肯定存在的离子有H+、NH4+、Ba2+、I-.溶液中不能确定是否存在的离子有K+、Cl-.

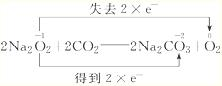 .
.