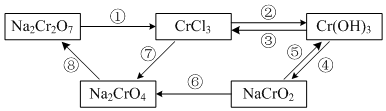
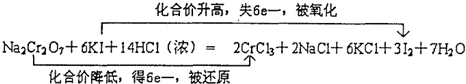
题目内容
12.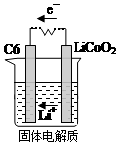 某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )
某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,电池反应为CoO2+Li C6$?_{放电}^{充电}$LiCoO2+C6.右图表示该装置工作时电子和离子的移动方向,此时C6电极是作为( )| A. | 阴极 | B. | 阳极 | C. | 负极 | D. | 正极 |
分析 充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,则Li+在阴极发生得电子的氧化反应,据此分析.
解答 解:充电时,Li+还原为Li,并以原子形式嵌入电极材料碳C6中,以LiC6表示,则Li+在阴极发生得电子的氧化反应,由图可知,Li+向C6电极,则C6电极是作为阴极,
故选A.
点评 本题考查了电解池原理的应用,题目难度不大,侧重于考查学生的分析能力和应用能力,注意把握阴阳极的判断.

练习册系列答案
相关题目
2.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A. | NaNO3 | B. | NaOH | C. | HCl | D. | NaCl |
3.利用硫酸钾、硫酸镁、硫酸铝三种溶液分别与相同体积、相同浓度的氯化钡溶液反应使Ba2+恰好完全沉淀,需要三种溶液的体积比为3:2:2,则三种溶液的溶质的物质的量浓度之比为( )
| A. | 3:4:2 | B. | 2:3:3 | C. | 6:3:1 | D. | 2:3:1 |
20.(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(2)下表是几种常见弱酸的电离平衡常数(25℃)
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是CH3COOH>H2CO3>HClO;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是NaAc<NaClO<Na2CO3.
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
(2)下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
7.有关下列两种溶液的说法中,正确的是
①0.1mol/L CH3COONa溶液 ②0.1mol/L CH3COOH溶液( )
①0.1mol/L CH3COONa溶液 ②0.1mol/L CH3COOH溶液( )
| A. | 常温时,溶液中c(CH3COO-):①<② | |
| B. | 加水稀释①,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| C. | 向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动 | |
| D. | 向②中滴加①至溶液呈中性,溶液中c(Na+)>c(CH3COO-) |
17.向四支试管中分别加入少量不同溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加2滴KSCN溶液,再滴几滴新制的氯水 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| D | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中有 CO32- |
| A. | A | B. | B | C. | C | D. | D |
2.不属于定量仪器的是( )
| A. | 滴定管 | B. | 量筒 | C. | 电子天平 | D. | 烧杯 |
 ;
;