题目内容
19.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )| A. | 在0.1mol/L的NaHSO4溶液中,含阳离子总数为0.2NA | |
| B. | 由2gH2、88gCO2、36gH2O组成的混合气体,密度约是相同状况下O2密度的0.79倍 | |
| C. | 1molAl与足量Na0H溶液反应生成H2的体积为33.6L | |
| D. | 56gFe单质与足量S单质在加热条件下充分反应,转移电子数为3NA |
分析 A.溶液体积未知;
B.先根据M=$\frac{m}{M}$求混合气体的平均摩尔质量,根据密度之比等于摩尔质量之比来解答;
C.气体状况未知;
D.铁与硫反应生成硫化亚铁.
解答 解:A.溶液体积未知,无法计算阳离子数目,故A错误;
B.2gH2、88gCO2、36gH2O物质的量分别为1mol,2mol,2mol,平均摩尔质量为:$\frac{(2+88+36)g}{5mol}$=25.2g/mol,密度约是相同状况下O2密度的:$\frac{25.2}{32}$=0.79,故B正确;
C.气体状况未知,无法计算氢气的物质的量,故C错误;
D.铁与硫反应生成硫化亚铁,56g铁生成1mol二价铁离子,转移电子数为3NA,故D错误;
故选B.
点评 本题考查了物质的量有关计算,明确以物质的量为核心计算公式、熟悉相对密度概念、气体摩尔体积使用条件和对象是解题关键,题目难度中等.

练习册系列答案
相关题目
9.下列可用于直接加热的玻璃仪器是( )
| A. | 试管 | B. | 量筒 | C. | 烧杯 | D. | 圆底烧瓶 |
10.已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr
利用这一反应,下列所给化合物中可以与钠反应合成环丁烷的是( )
①CH3Br ②CH2BrCH2CH2CH2Br ③CH2BrCH2Br ④CH3CH2CH2CH2Br ⑤CH3CH2BrCHCH2Br.
利用这一反应,下列所给化合物中可以与钠反应合成环丁烷的是( )
①CH3Br ②CH2BrCH2CH2CH2Br ③CH2BrCH2Br ④CH3CH2CH2CH2Br ⑤CH3CH2BrCHCH2Br.
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③ | D. | ①②③④⑤ |
7.有关下列两种溶液的说法中,正确的是
①0.1mol/L CH3COONa溶液 ②0.1mol/L CH3COOH溶液( )
①0.1mol/L CH3COONa溶液 ②0.1mol/L CH3COOH溶液( )
| A. | 常温时,溶液中c(CH3COO-):①<② | |
| B. | 加水稀释①,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$变大 | |
| C. | 向②中滴加①至溶液呈中性,滴加过程中水的电离平衡正向移动 | |
| D. | 向②中滴加①至溶液呈中性,溶液中c(Na+)>c(CH3COO-) |
11.在同温同压下,下列各组热化学方程式中,△H2>△H1 的是( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2 |
8.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与Cl-的浓度之比为1:6,则Cl2与NaOH溶液反应时被还原的氯与被氧化的氯的物质的量之比为( )
| A. | 21:5 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
1.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):
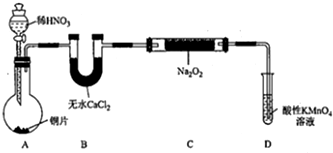
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(2)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=2NO2.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A、B装置增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.分别称量0.10g制得的样品溶于水配成500mL溶液.取5mL待测液,加入1mL M溶液,再加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与③号色阶相同,则甲同学制得的样品中NaNO2的质量分数是40%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):

(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(2)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=2NO2.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A、B装置增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(4)步骤b中比较结果是:待测液颜色与③号色阶相同,则甲同学制得的样品中NaNO2的质量分数是40%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
 火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.
火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的. ;
;