题目内容
14.铁和铜是生活中两种常见的金属材料,某同学查阅资料得知铁主要是由铁矿石经热还原的方法冶炼的,常见的铁矿石有磁铁矿、赤铁矿、黄铁矿(主要成分为FeS2)等.(1)赤铁矿的主要成分为Fe2O3(填化学式),工业上用赤铁矿冶炼铁的化学反应方程式为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ;
(2)从矿物资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4;
该反应中氧化剂是CuSO4和FeS2(填化学式),当有5molFeS2发生反应时,电子转移数为21NA;
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,用FeCl3溶液作“腐蚀液”,请写出刻制过程的离子方程式Cu+2Fe3+=2Fe2++Cu2+.
分析 (1)赤铁矿的主要成分为氧化铁,工业上用一氧化碳还原赤铁矿冶炼铁,同时生成二氧化碳,根据元素守恒书写化学方程式;
(2)在氧化还原反应中元素化合价降低的作氧化剂,根据氧化还原反应方程中元素的化合价的变化等于转移电子数目进行判断;
(3)刻制印刷电路时,用FeCl3溶液与铜反应生成亚铁离子和铜离子,根据电荷守恒和元素守恒书写反应的离子方程.
解答 解:(1)赤铁矿的主要成分为氧化铁,化学式为Fe2O3,工业上用一氧化碳还原赤铁矿冶炼铁,同时生成二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ,
故答案为:Fe2O3;Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ;
(2)在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,铜从+2价降为+1价,硫从-1价降为-2价,所以反应中氧化剂为CuSO4和FeS2,反应中化合价降低的总数为14×1+7×1=21,即当有5molFeS2发生反应时,电子转移的物质的量为21mol,数目为21NA,
故答案为:CuSO4和FeS2;21NA;
(3)刻制印刷电路时,用FeCl3溶液与铜反应生成亚铁离子和铜离子,反应的离子方程为Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+.
点评 本题综合考查元素化合物、氧化还原反应分析等,为高考常见题型,把握发生的化学反应为解答的关键,侧重氧化还原反应的考查,注意离子反应的书写方法,题目难度不大.

练习册系列答案
相关题目
4.下列化合物属于弱电解质的是( )
| A. | HCl | B. | Ba(OH)2 | C. | CO2 | D. | NH3•H2O |
5.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1的是( )
| A. | 苯 | B. | 乙酸乙酯 | C. | 乙醛 | D. | 对二甲苯 |
2.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是( )
| A. | NaNO3 | B. | NaOH | C. | HCl | D. | NaCl |
9.下列可用于直接加热的玻璃仪器是( )
| A. | 试管 | B. | 量筒 | C. | 烧杯 | D. | 圆底烧瓶 |
19.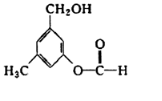 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
①可以使溴水褪色
②可以和NaHCO3溶液反应
③在一定条件下可以和氢气发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以发生银镜反应.
 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )①可以使溴水褪色
②可以和NaHCO3溶液反应
③在一定条件下可以和氢气发生反应
④在一定条件下可以发生消去反应
⑤在一定条件下可以发生银镜反应.
| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
6.等质量两份铝,分别放入足量盐酸和NaOH 中,生成氢气在同温同压下体积比为( )
| A. | 2:3 | B. | 3:2 | C. | l:1 | D. | l:6 |
3.利用硫酸钾、硫酸镁、硫酸铝三种溶液分别与相同体积、相同浓度的氯化钡溶液反应使Ba2+恰好完全沉淀,需要三种溶液的体积比为3:2:2,则三种溶液的溶质的物质的量浓度之比为( )
| A. | 3:4:2 | B. | 2:3:3 | C. | 6:3:1 | D. | 2:3:1 |
 ;
;