题目内容
15.下列有关说法正确的是( )| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,粗铜作阳极,精铜作阴极 | |
| C. | 在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | CH3COOH溶液加水稀释后,电离度增大,溶液中$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变 |
分析 A.该反应的△S<0,能自发进行,则△H-T△S<0;
B.电解精炼铜时粗铜作阳极,纯铜为阴极;
C.难溶物若满足Qc>Ksp,可生成沉淀;
D.醋酸稀释后电离程度增大,由于温度不变,则电离平衡常数K=$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变.
解答 解:A.反应2Mg(s)+CO2(g)═C(s)+2MgO(s)的△S<0,该反应能够自发进行,则△H-T△S<0,说明△H<0,故A错误;
B.电解法精炼铜时,阳极失去电子发生氧化反应,则粗铜作阳极,精铜作阴极,故B正确;
C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明有碳酸钡沉淀生成,是因为碳酸根离子浓度大,和钡离子浓度乘积等于碳酸钡的Ksp,实际Ksp(BaSO4)小于Ksp(BaCO3),故C错误;
D.CH3COOH溶液加水稀释后,醋酸的电离度增大,由于温度不变,在稀释后的溶液中醋酸的电离平衡常数K=$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变,故D正确;
故选BD.
点评 本题考查较为综合,涉及难溶物溶解评价、电离平衡常数及其影响、电解原理、反应自发进行的判断等知识,明确难溶物溶解平衡及其影响为解答关键,注意掌握判断反应能否自发进行的方法.

练习册系列答案
相关题目
12.利用右图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 | 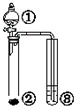 | |
| A. | 硫酸 | Na2SO3 | KMnO4 | SO2有漂白性 | |
| B. | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C. | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D. | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
13.将等物质的量的Na、Na2O、Na2O2、NaOH放入等质量的足量水中制成NaOH溶液,编号依次是甲、乙、丙、丁,所得的溶液中溶质的质量分数的说法正确的是( )
| A. | 甲=乙=丙=丁 | B. | 乙=丙>甲=丁 | C. | 乙>丙>甲>丁 | D. | 乙=丙>甲>丁 |
3.汞(熔点-39℃,沸点356℃)是制造电池、电极的重要原料,历史上曾用“灼烧辰砂法”制取汞.目前工业上制粗汞的一种流程图如图.下列分析错误的是( )


| A. | 洗涤粗汞可用5%的盐酸代替5%的硝酸 | |
| B. | 辰砂与氧化钙加热反应时,CaSO4为氧化产物 | |
| C. | “灼烧辰砂法”过程中电子转移的方向和数目可表示为: | |
| D. | 减压蒸馏的目的是降低汞的沸点,提高分离效率 |
10.下列物质中,既含有共价键又含有离子键的是( )
| A. | HF | B. | NaCl | C. | HCl | D. | KOH |
7.从柑橘中提取得到结构简式如图所示的化合物,则下列有关它的推断错误的是( )
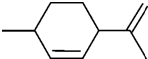

| A. | 属于芳香烃,分子式为C10H16 | B. | 常温下呈液态,比水轻 | ||
| C. | 其一氯代物有8种(不考虑顺反异构) | D. | 能与溴水发生加成反应 |
5.物质的量浓度相同(0.2mol/L)的弱酸HX与NaX溶液等体积混合后,溶液中微粒浓度关系错误的是( )
| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | c(HX)+c(X-)=c(Na+) | |
| C. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| D. | 若混合液呈酸性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |

 .
.