题目内容
5.物质的量浓度相同(0.2mol/L)的弱酸HX与NaX溶液等体积混合后,溶液中微粒浓度关系错误的是( )| A. | c(Na+)+c(H+)=c(X-)+c(OH-) | |
| B. | c(HX)+c(X-)=c(Na+) | |
| C. | 若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| D. | 若混合液呈酸性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+) |
分析 A.根据溶液中的电荷守恒判断;
B.根据溶液中的物料守恒判断;
C.混合液呈酸性,说明HX的电离程度大于X-的水解程度,则c(H+)>c(OH-)、c(X-)>c(Na+)>c(HX);
D.根据C的分析可知c(X-)>c(Na+)>c(HX).
解答 解:A.根据电荷守恒可知:c(Na+)+c(H+)=c(X-)+c(OH-),故A正确;
B.根据物料守恒可得:c(HX)+c(X-)=2c(Na+),故B错误;
C.混合液为酸性,说明HX的电离程度大于X-的水解程度,则c(H+)>c(OH-)、c(X-)>c(Na+)>c(HX),溶液中离子浓度大小为:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故C正确;
D.根据C可知,溶液若呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),故D错误;
故选BD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
15.下列有关说法正确的是( )
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,粗铜作阳极,精铜作阴极 | |
| C. | 在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | CH3COOH溶液加水稀释后,电离度增大,溶液中$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变 |
16.H2和 I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ/mol.已知:

(a、b、c 均大于零).下列说法正确的是( )

(a、b、c 均大于零).下列说法正确的是( )
| A. | H2、I2和 HI 分子中的化学键都是非极性共价键 | |
| B. | 断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和 1mol I2(g)总能量小于 2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为 2a kJ |
20.pH=5的NH4Cl溶液由水电离出来的H+离子浓度为a mol•L-1,pH=5的HCOOH溶液由水电离出来的H+离子浓度为b mol•L-1,下列a和b的关系正确的是( )
| A. | a=b | B. | a=10-4b | C. | a=104b | D. | 无法确定 |
10.下列有关金属的用途,其中利用的是金属的化学性质的是( )
| A. | 铜--电线 | B. | 铝--反射镜 | ||
| C. | 铁--回收溶液中的银 | D. | 不锈钢--炊具 |
17.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1的Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(CO32-) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) | |
| D. | 常温下,CH3COOH)和CH3COONa混合溶液【PH=7,c(Na+)=0.1mol•L-1】:c(CH3COO-)=0.1mol•L-1 |
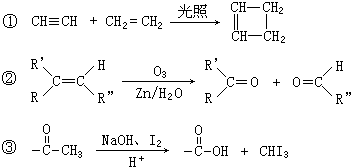
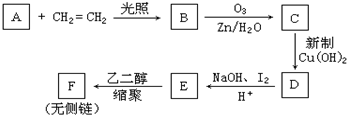
 ,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F
,CCH3COCH2CH2CHO,DCH3COCH2CH2COOH,F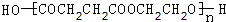 .
.