题目内容
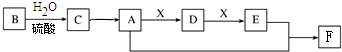
13.将等物质的量的Na、Na2O、Na2O2、NaOH放入等质量的足量水中制成NaOH溶液,编号依次是甲、乙、丙、丁,所得的溶液中溶质的质量分数的说法正确的是( )| A. | 甲=乙=丙=丁 | B. | 乙=丙>甲=丁 | C. | 乙>丙>甲>丁 | D. | 乙=丙>甲>丁 |
分析 可以根据将等物质的量的甲Na、乙Na2O、丙Na2O2、丁NaOH中金属钠的量的多少来确定所得溶质的质量大小,并根据和水的反应情况结合溶液质量来确定溶质的质量分数或是浓度关系.
解答 解:质量比等于摩尔质量比,即各物质的物质的量相同,
设4种物质的物质的量为amol,则Na2O2和Na2O都含有2molNa,所以这两种物质形成的溶液中溶质的物质的量浓度最大,并且Na2O2和水反应生成了O2,所以相当于Na2O,两者是等价的,即氧化钠和过氧化钠所得溶质的物质的量浓度相等,
等物质的量的Na质量比NaOH小,且金属钠和水反应生成H2,所以所得溶质的物质的量浓度是Na>NaOH,即得到四种溶液中溶质的物质的量浓度关系是Na2O=Na2O2>Na>NaOH,乙=丙>甲>丁,
故选D.
点评 本题考查学生金属钠和化合物的性质知识,难度不大.注意守恒思想的灵活运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列有关物质分类或归纳不正确的是( )
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
5.下列说法正确的是( )
| A. | 16gO2所含的分子数为6.02×1023个 | |
| B. | 0.5molH2SO4含有的原子数目为3.5NA | |
| C. | 18gH2O中原子的物质的量为1mol | |
| D. | 22g物质A中含有分子数为3.01×1023,则A的摩尔质量为44g |
15.下列有关说法正确的是( )
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,粗铜作阳极,精铜作阴极 | |
| C. | 在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | CH3COOH溶液加水稀释后,电离度增大,溶液中$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变 |
16.H2和 I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ/mol.已知:

(a、b、c 均大于零).下列说法正确的是( )

(a、b、c 均大于零).下列说法正确的是( )
| A. | H2、I2和 HI 分子中的化学键都是非极性共价键 | |
| B. | 断开 2 mol HI 分子中的化学键所需能量约为(c+b+a) kJ | |
| C. | 相同条件下,1 mol H2(g)和 1mol I2(g)总能量小于 2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入 2 mol H2(g)和 2 mol I2(g),充分反应后放出的热量为 2a kJ |
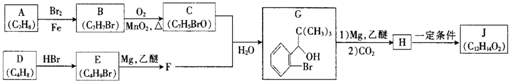
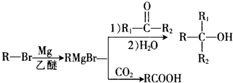
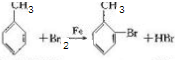 ,其反应类型为取代反应
,其反应类型为取代反应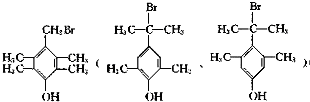 (其中一种)(写出一种即可)
(其中一种)(写出一种即可)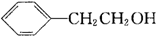 唑I.反应条件1为Br2、光照;反应条件2所选择的试剂为镁、乙醚;L的结构简式为
唑I.反应条件1为Br2、光照;反应条件2所选择的试剂为镁、乙醚;L的结构简式为 .
.