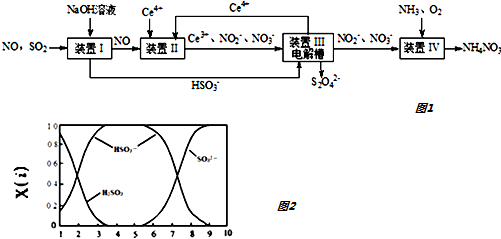
题目内容
8.在固态金属氧化物电解池中,高温共电解H20-CO2湿合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
分析 与X相连的电极产生CO,说明二氧化碳被还原,则X为电源的负极,Y为正极,由图示可知反应的总方程式为H2O+CO2═H2+CO+O2,以此解答该题.
解答 解:A.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故A正确;
B.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故B正确;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D错误;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.

练习册系列答案
相关题目
5.下列化学方程式或离子方程式不正确的是( )
| A. | S与Cu反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 酸雨放置过程中pH变小:2H2SO3+O2═2H2SO4 | |
| C. | 亚硫酸氢钙溶液与澄清的石灰水混合:Ca2++HSO3-+OH-═CaSO3↓+H2O | |
| D. | 向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S):n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O |
19.下列说法正确的是( )
| A. | 除去N2中的O2:通过灼热的CuO粉末,收集气体 | |
| B. | 某吸热反应能自发进行,则该反应一定是熵增的反应 | |
| C. |  如图是从化学试剂商店买回的硫酸试剂标签,配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL | |
| D. | 下列各种物质在一定条件下反应,所得产物与反应物的用量或与反应条件无关①Na2SiO3+CO2+H2O ②Fe+Cl2 ③Ca(HCO3)2+Ca(OH)2 |
16.玻璃的主要成分是二氧化硅,能在玻璃上进行雕刻的物质是( )
| A. | 纯碱 | B. | 盐酸 | C. | 氢氟酸 | D. | 硫酸 |
3.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 用该硫酸配制稀硫酸时必须用到托盘天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol•L-1 |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{c({H}^{+})}{c(OH)}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
20.下列变化过程中,在常温下加入还原剂就能实现的是( )
| A. | Ag+→Ag | B. | CuO→Cu2+ | C. | SO2→SO3 | D. | CO→CO2 |
18.下列条件下,两瓶气体所含的原子数一定相等的是( )
| A. | 同质量、不同密度的O2和O3 气体 | B. | 同温度、同体积的O2和O3气体 | ||
| C. | 同压强、同体积的N2O和CO2气体 | D. | 同体积、同密度的N2O和CO2气体 |