题目内容
3.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 用该硫酸配制稀硫酸时必须用到托盘天平 | |
| C. | 配制200mL 4.6mol/L的稀硫酸需量取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol•L-1 |
分析 A.根据c=$\frac{1000ρω}{M}$计算该硫酸溶液的物质的量浓度;
B.硫酸为液态,用量筒量取,不需要使用托盘天平;
C.根据溶液稀释前后溶质的物质的量不变分析.
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,据此判断.
解答 解:A.该硫酸溶液的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故A错误;
B.硫酸为液态,不需要托盘天平,应该用量筒量取浓硫酸,故B错误;
C.设配制200mL4.6mol•L-1的稀硫酸需取该硫酸的体积为xL,根据溶液稀释前后溶质的物质的量不变可知:0.20L×4.6mol/L=x×18.4mol/L,解得:x=0.05L=50mL,故C正确;
D.硫酸的浓度越小密度越小,该硫酸与等质量的水混合所得溶液质量为原硫酸溶液的2倍,密度小于原硫酸溶液,故混合后溶液的体积大于原硫酸溶液的2倍,稀释后溶质硫酸不变,所得溶液的物质的量浓度小于9.2mol/L,故D错误;
故选C.
点评 本题考查物质的量浓度的有关计算,题目难度不大,明确物质的性质、溶液稀释特点等知识点即可解答,易错选项是D,浓硫酸浓度越大其密度越大,氨水浓度越大其密度越小.

练习册系列答案
相关题目
20.将0.51 mol铜与250 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.待产生的气体全部释放后,向溶液中加入300 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是( )
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
14.下列污水处理过程,不涉及化学变化的是( )
| A. | 加入明矾净水 | B. | 过滤水中的不溶物 | ||
| C. | 调节水的pH | D. | 沉淀水中的Cu2+离子 |
11.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: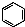 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$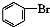 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
18.下列说法中错误的是( )
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |
8.在固态金属氧化物电解池中,高温共电解H20-CO2湿合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
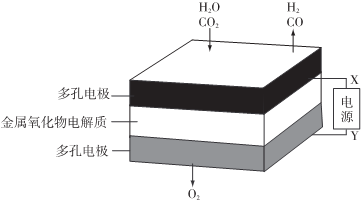

| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
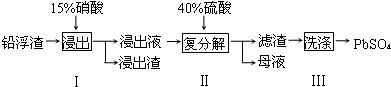
15.废弃物的综合利用既有利于节约资源,又有利于保护环境.工业上利用铅浮渣(主要成分是PbO、Pb还古有少量的Ag、CaO)可制备硫酸铅.制备流程图如下:
下表是25℃时某些盐的浓度积常数:
(1)实验室用75%的硝酸来配制15%的硝酸溶液,不需用到的玻璃仪器有CD(填标号).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.

下表是25℃时某些盐的浓度积常数:
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.
12.三氯化氮(NCl3)常温是一种淡黄色液体,以下关于三氯化氮说法正确的是( )
| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
