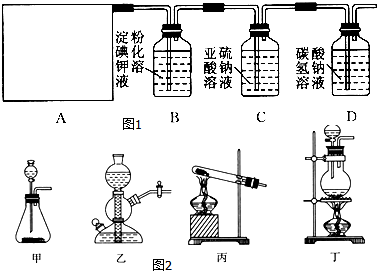
题目内容
5.下列化学方程式或离子方程式不正确的是( )| A. | S与Cu反应:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | |
| B. | 酸雨放置过程中pH变小:2H2SO3+O2═2H2SO4 | |
| C. | 亚硫酸氢钙溶液与澄清的石灰水混合:Ca2++HSO3-+OH-═CaSO3↓+H2O | |
| D. | 向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S):n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O |
分析 A.硫与铜反应生成硫化亚铜;
B.亚硫酸不稳定容易被氧化生成硫酸;
C.二者反应生成亚硫酸钙和水;
D.二者在酸性环境下发生氧化还原反应生成硫单质和水.
解答 解:A.S与Cu反应,化学方程式:Cu+2S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,故A错误;
B.酸雨放置过程中pH变小是因为亚硫酸不稳定容易被氧化生成硫酸,化学方程式:2H2SO3+O2═2H2SO4,故B正确;
C.亚硫酸氢钙溶液与澄清的石灰水混合,离子方程式:Ca2++HSO3-+OH-═CaSO3↓+H2O,故C正确;
D.向Na2S和Na2SO3的混合溶液中滴加稀H2SO4[n(Na2S),离子方程式:n(Na2SO3)=2:1]:2S2-+SO32-+6H+═3S↓+3H2O,故D正确;
故选:A.
点评 本题考查了离子方程式、化学方程式的书写,明确物质的性质及发生反应的实质是解题关键,注意硫氧化性较弱与变价金属反应得到低价态硫化物,题目难度不大.

练习册系列答案
相关题目
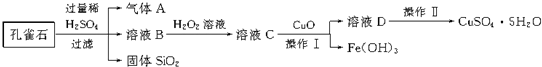
15.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
16.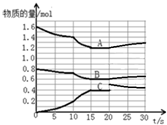 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
20.将0.51 mol铜与250 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.待产生的气体全部释放后,向溶液中加入300 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是( )
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
8.在固态金属氧化物电解池中,高温共电解H20-CO2湿合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
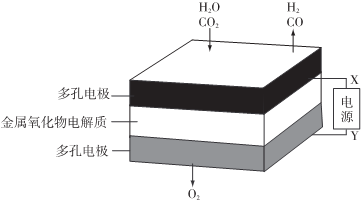

| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.