题目内容
18.下列条件下,两瓶气体所含的原子数一定相等的是( )| A. | 同质量、不同密度的O2和O3 气体 | B. | 同温度、同体积的O2和O3气体 | ||
| C. | 同压强、同体积的N2O和CO2气体 | D. | 同体积、同密度的N2O和CO2气体 |
分析 A.O2和O3 都是由氧原子构成;
B.同温、同体积时,两种气体的压强之比等于其物质的量之比;
C.同压、同体积时,两种气体的温度之比与其物质的量成反比;
D.同体积、同密度的N2O和CO2的质量相等,根据N=nNA=$\frac{m}{M}$NA再结合分子构成计算.
解答 解:A.同质量的O2和O3,O原子的物质的量相同,则数目相同,故A正确;
B.同温、同体积时,两种气体的压强之比等于其物质的量之比,因为压强未知,所以其物质的量之比无法计算,导致其原子个数之比无法计算,故B错误;
C.同压、同体积时,两种气体的温度之比与其物质的量成反比,因为温度未知,所以无法计算其物质的量之比,则其原子个数之比无法计算,故C错误;
D.同体积、同密度的N2O和CO2的质量相等,根据N=nNA=$\frac{m}{M}$NA可知,相同质量时,二者的分子数之比等于其摩尔质量的反比=1:1,结合分子构成知,其原子个数之比=1:1,故D正确;
故选AD.
点评 本题考查了阿伏伽德罗定律及其推论,注意同温、同压、同体积、同分子数的相互制约,只有“三同”成立,第“四同”才能成立,即“三同”定“一同”.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
8.在固态金属氧化物电解池中,高温共电解H20-CO2湿合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
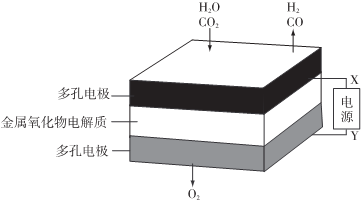

| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
9.已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:第一步:H2O2+I-→H2O+IO- (慢);第二步:H2O2+IO-→H2O+O2+I- (快),下列有关反应的说法正确的是( )
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |
6.下列有关物质性质或应用的说法正确的是( )
| A. | 医疗上,常用碳酸钠治疗胃酸过多 | |
| B. | 在海轮外壳上安装锌块以减缓船体腐蚀 | |
| C. | 液氨汽化放出大量的热,可用作制冷剂 | |
| D. | 明矾具有强氧化性,常用于自来水的杀菌消毒 |
3.下列说法中,不正确的是( )
| A. | 化学反应中既有物质变化又有能量变化 | |
| B. | 物质发生变化时,即使没有发生化学变化,也可能有能量的变化 | |
| C. | 任何化学反应中的能量变化都表现为放出热量或吸收热量 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
7.下列说法中正确的是( )
| A. | NA个N2分子和NA个CO分子的质量之比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对分子质量之和 | |
| C. | 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同 | |
| D. | 1 mol N2的质量等于NA个氮原子的质量 |
8. Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
(Ⅰ) 某同学利用乙醛与新制氢氧化铜加热制的砖红色沉淀.
①乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
②砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
③砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
(Ⅱ) Cu2O常用电解法制备,流程如下:
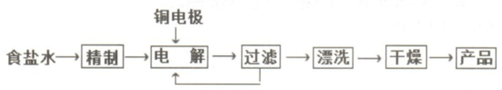
(1)精制食盐水需要除去其中的钙镁离子,依次加入的试剂为NaOH、Na2CO3、HCl.
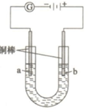
(2)实验室模拟电解装置如图,观察的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
则:ⅰ)电解池的阳极反应式为Cu+Cl--e-=CuCl↓.ⅱ)b极附近的白色沉淀开始变成黄色,颜色变化的离子方程式为CuCl+OH-=CuOH+Cl-.
此时溶液中c(OH-)/c(Cl-)=8.3×10-9.
(3)Cu2O在潮湿空气中容易被氧气氧化为CuO而变质,请设计实验方案检验其是否变质:加入足量浓盐酸,溶液变为绿色,则含有CuO.
 Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:
Cu2O为暗红色固体,有毒,它是一种用途广泛的材料. Y已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O ②部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
①乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
②砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
③砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
(Ⅱ) Cu2O常用电解法制备,流程如下:

(1)精制食盐水需要除去其中的钙镁离子,依次加入的试剂为NaOH、Na2CO3、HCl.
(2)实验室模拟电解装置如图,观察的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
则:ⅰ)电解池的阳极反应式为Cu+Cl--e-=CuCl↓.ⅱ)b极附近的白色沉淀开始变成黄色,颜色变化的离子方程式为CuCl+OH-=CuOH+Cl-.
此时溶液中c(OH-)/c(Cl-)=8.3×10-9.
(3)Cu2O在潮湿空气中容易被氧气氧化为CuO而变质,请设计实验方案检验其是否变质:加入足量浓盐酸,溶液变为绿色,则含有CuO.
