题目内容
20.下列变化过程中,在常温下加入还原剂就能实现的是( )| A. | Ag+→Ag | B. | CuO→Cu2+ | C. | SO2→SO3 | D. | CO→CO2 |
分析 需要加入还原剂才能实现,则选项中氧化剂在反应中元素的化合价降低,以此来解答.
解答 解:A.Fe元素化合价降低,被还原,应加入还原剂,故A正确;
B.元素化合价不变,不是氧化还原反应,故B错误;
C.S元素化合价升高,被氧化,应加入氧化剂,故C错误;
D.C元素化合价升高,被氧化,应加入氧化剂,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化解答的关键,侧重还原反应的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
11.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: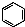 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$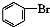 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
8.在固态金属氧化物电解池中,高温共电解H20-CO2湿合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
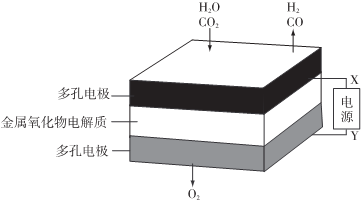

| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
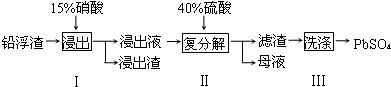
15.废弃物的综合利用既有利于节约资源,又有利于保护环境.工业上利用铅浮渣(主要成分是PbO、Pb还古有少量的Ag、CaO)可制备硫酸铅.制备流程图如下:
下表是25℃时某些盐的浓度积常数:
(1)实验室用75%的硝酸来配制15%的硝酸溶液,不需用到的玻璃仪器有CD(填标号).
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.

下表是25℃时某些盐的浓度积常数:
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
A.烧杯 B.量筒 C.容量瓶 D.锥形瓶 E.玻璃棒
(2)步骤I有NO产生,浸出液中含量最多的金属阳离子为 Pb2+,写出Pb参加反应的化学方程式
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O,为防止Ag被溶解进入溶液,步骤I操作时应注意控制硝酸的用量并使Pb稍有剩余.
(3)母液可循环利用于步骤I,其溶质主要是HNO3(填一种物质化学式),若母液中残留的 SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)粗PbSO4 产品含有的杂质是硫酸钙,需用Pb(NO3)2溶液多次洗涤,以得到纯净的PbSO4.
(5)铅蓄电池放电时正极的电极反应式为PbO2+2e-+4H++SO42-=PbSO4+2H2O.如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸涪液浓度为4.50mol•L-1,当制得4.48LCl2时(在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)4 mol•L-1.
5.下列溶液中,C(OH-)最小的是( )
| A. | 向0.1mol•L-1的氨水中加入同体积的水 | |
| B. | 向0.1mol•L-1的KOH溶液中加入同体积的水 | |
| C. | 向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸 | |
| D. | 向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸 |
12.三氯化氮(NCl3)常温是一种淡黄色液体,以下关于三氯化氮说法正确的是( )
| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
9.已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:第一步:H2O2+I-→H2O+IO- (慢);第二步:H2O2+IO-→H2O+O2+I- (快),下列有关反应的说法正确的是( )
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |