题目内容
17.二氧化硫、一氧化氮是大气污染物.吸收二氧化硫和一氧化氮,获得Na2S2O4和NH4NO3产品的流程图如图1(Ce为铈元素):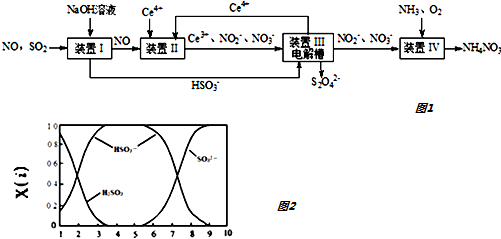
(1)装置Ⅰ中生成HSO3-的离子方程式为SO2+OH-=HSO3-.
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于二氧化硫与氢氧化钠溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图2所示.
①下列说法正确的是ac(填字母序号).
A. pH=8时,溶液中c(HSO3-)<c(SO32-)
B. pH=7时,溶液中 c(Na+)=c(HSO3-)+c(SO32-)
C. 为获得尽可能纯的NaHSO3,可将溶液的pH控制在4-5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液降低的原因:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大.
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式NO+2H2O+3Ce4+=3Ce3++NO3-+4H+.
分析 (1)二氧化硫是酸性氧化物,能和强碱之间发生反应;
(2)①当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,根据离子浓度大小比较的方法来回答;
②NaHSO3溶液中HSO3-的电离大于水解,溶液显示酸性,根据平衡移动原理来回答;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应;
解答 解:(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,故答案为:SO2+OH-=HSO3-;
(2)①a、当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),c(SO32-)>c(HSO3-),故a正确;
b.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故b错误;
c.图象可知,为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右.故c正确;
故答案为:ac;
②NaHSO3溶液中HSO3-的电离大于水解,HSO3-?SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,
故答案为:HSO3-在溶液中存在电离平衡:HSO3-?SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(3)在酸性环境下,NO和Ce4+之间会发生氧化还原反应:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,
故答案为:NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
点评 本题综合考查学生含氮元素、含硫元素物质的性质知识,注意知识的梳理和归纳是关键,难度中等.

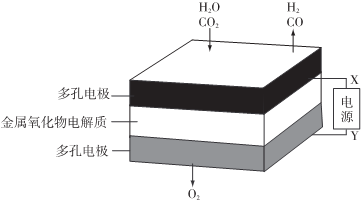
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
| A. | 向0.1mol•L-1的氨水中加入同体积的水 | |
| B. | 向0.1mol•L-1的KOH溶液中加入同体积的水 | |
| C. | 向0.2mol•L-1的氨水中加入同体积的0.1mol•L-1盐酸 | |
| D. | 向0.2mol•L-1的KOH溶液中加入同体积的0.1mol•L-1盐酸 |
| A. | 其分子结构呈三角形 | B. | 分子中不存在孤对电子 | ||
| C. | 它的沸点比三氯化磷沸点低 | D. | 三氯化氮水解有硝酸生成 |
| A. | Na+、Al3+、OH-、Br- | B. | H+、Fe2+、SO42-、CO32- | ||
| C. | K+、NH4+、CO32-、OH- | D. | Ca2+、Al3+、NO3-、Cl- |
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |
| A. | 医疗上,常用碳酸钠治疗胃酸过多 | |
| B. | 在海轮外壳上安装锌块以减缓船体腐蚀 | |
| C. | 液氨汽化放出大量的热,可用作制冷剂 | |
| D. | 明矾具有强氧化性,常用于自来水的杀菌消毒 |
| A. | NA个N2分子和NA个CO分子的质量之比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对分子质量之和 | |
| C. | 分别由NA个水分子组成的水、冰、水蒸气的质量各不相同 | |
| D. | 1 mol N2的质量等于NA个氮原子的质量 |