题目内容
20.钠、铝、碳、硅是四种常见的化学元素.请回答下列问题:(1)五种元素中,原子半径最大的是Na(填元素符号),单质广泛用作半导体材料的是Si(填化学式).
(2)铝在周期表中位于第三周期第IIIA族,氧化铝在另三种元素之一的最高价氧化物对应的水化物溶液中可溶解,写出反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(3)工业上由下列物质冶炼相应金属时与冶炼铝采用相同方法的是BC(填选项代号).
A.Fe2O3 B.MgCl2 C.NaCl D.HgO
(4)生产上常利用金属铝与Fe2O3在高温下的反应来进行焊接钢轨,请写出该反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
分析 (1)电子层数越多半径大,电子层相同时核电荷数越小,半径越大;单质广泛用作半导体材料的是硅;
(2)铝是13号元素,三个电子层,最外层三个电子;氧化铝是两性氧化物,可与强酸强碱反应,所以可溶于氢氧化钠;
(3)电解法:冶炼活泼金属(K、Ca、Na、Mg、Al),一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
(4)Al与氧化铁在高温下反应生成氧化铝与Fe,该反应为铝热反应,放出大量的热.
解答 解:(1)电子层数越多半径大,电子层相同时核电荷数越小,半径越大,所以在钠、铝、碳、硅的半径大小为:钠、铝、硅、碳;单质广泛用作半导体材料的是硅,故答案为:Na;Si;
(2)铝是13号元素,三个电子层,最外层三个电子,所以铝在周期表中位于第三周期第IIIA族,;氧化铝是两性氧化物,可与强酸强碱反应,所以可溶于氢氧化钠,反应的方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:三;IIIA;Al2O3+2OH-=2AlO2-+H2O;
(3)电解法:冶炼活泼金属(K、Ca、Na、Mg、Al),一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得,所以MgCl2和NaCl用电解制得,故选BC;
(4)Al与氧化铁在高温下反应生成氧化铝与Fe,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为铝热反应,放出大量的热,属于放热反应,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查元素周期表和金属的冶炼,题目难度不大,注意根据金属的活泼性确定金属的冶炼方法.注意铝是活泼金属,采用电解法冶炼.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.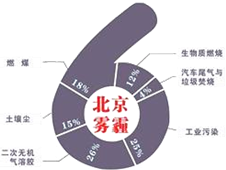 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
5.根据化合价判断下列加点元素只能表现氧化性的是( )
| A. | H$\underset{\stackrel{\;}{C}}{•}$$\underset{\stackrel{\;}{l}}{•}$ | B. | $\underset{\stackrel{\;}{F}}{•}$$\underset{\stackrel{\;}{e}}{•}$Cl2 | C. | K$\underset{\stackrel{\;}{M}}{•}$$\underset{\stackrel{\;}{n}}{•}$O4 | D. | Na2$\underset{\stackrel{\;}{S}}{•}$O3 |
9.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子. | |
| B. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| C. | 溶于水后电离出氢离子的化合物都是酸 | |
| D. | 二氧化碳的水溶液能导电,故二氧化碳属于电解质 |

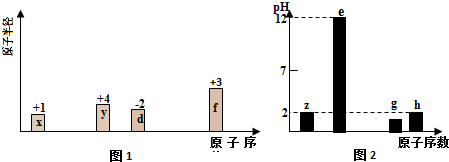
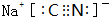 .
. ,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.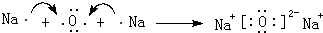 .
.