题目内容
13.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y与X形成的分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断:(1)各元素的元素符号:XH、YN、ZO、WNa.
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为
 ,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.(3)由X、Y、Z所形成的常见离子化合物是NH4NO3(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.X与W形成的化合物与水反应时,水是氧化剂(填“氧化剂”或“还原剂”).
(4)用电子式表示W与Z形成W2Z化合物的过程:
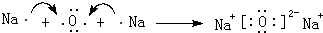 .
.
分析 X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大,Z原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;Y、Z为同周期的相邻元素,Y的原子序数小于氧,则Y为N元素;Y与X形成的分子中有3个共价键,则X为H元素;X、W同主族,处于ⅠA族,W的原子序数大于氧,故W为Na元素,W原子的质子数等于Y、Z原子最外层电子数之和,据此解答.
解答 解:X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大,Z原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;Y、Z为同周期的相邻元素,Y的原子序数小于氧,则Y为N元素;Y与X形成的分子中有3个共价键,则X为H元素;X、W同主族,处于ⅠA族,W的原子序数大于氧,故W为Na元素,W原子的质子数等于Y、Z原子最外层电子数之和.
(1)由上述分析可知,X为H元素、Y为N元素、Z为O元素、W为Na,
故答案为:H;N;O;Na;
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物为NH3,其电子式为 ,它的化学键属于共价键;含有离子键和非极性共价键的化合物Na2O2,
,它的化学键属于共价键;含有离子键和非极性共价键的化合物Na2O2,
故答案为: ;共价;Na2O2;
;共价;Na2O2;
(3)由H、N、O所形成的常见离子化合物是NH4NO3,W最高价氧化物对应水化物为NaOH,两种化合物的浓溶液混合共热的离子反应方程式为 NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,H与Na形成的化合物为NaH,将该化合物溶于水,发生反应:NaH+H2O═NaOH+H2↑,其中水中氢元素化合价降低,水做氧化剂,
故答案为:NH4NO3; ;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;氧化剂;
;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;氧化剂;
(4)用电子式表示Na2O化合物的形成过程: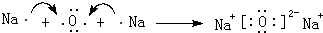 ,
,
故答案为: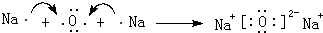 .
.
点评 本题考查结构性质位置关系,推断元素是解题关键,难度中等,(3)中根据水解原理NaH与水的反应,掌握用电子式表示化学键或物质的形成.

| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
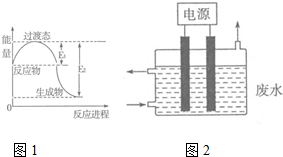 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
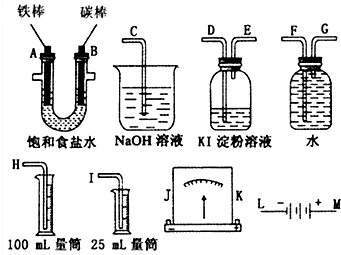 某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.
某课外小组做电解食盐水的探究实验,现有如图所示所列实验装置,请从其中选择适当的装置并加以组装,要求检验氯气的氧化性,并测定产生氢气的体积.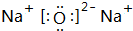 .
.


