题目内容
9.已知NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
分析 A、25℃时,pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L;
B、二氧化硫和氧气的反应为可逆反应;
C、将1molNH4NO3溶于稀氨水中使溶液呈中性,则有n(OH-)=n(H+),根据电荷守恒来分析;
D、乙烯中含有一条碳碳双键.
解答 解:A、25℃时,pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故A错误;
B、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故最终气体分子个数大于3NA个,故B错误;
C、将1molNH4NO3溶于稀氨水中,根据电荷守恒可知有:n(OH-)+n(NO3-)=n(H+)+n(NH4+),而溶液呈中性,则有n(OH-)=n(H+),故可知n(NO3-)=n(NH4+)=1mol,即铵根离子个数为NA个,故C正确;
D、由C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,可知乙烯与H2加成时放出68.5kJ热量时,反应掉0.5mol乙烯,而乙烯中含有一条碳碳双键,故被破坏的碳碳双键为0.5NA条,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20. 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T1<T2,P1>P2,m+n>p△Η<0 | B. | T1>T2,P1<P2,m+n<p△Η>0 | ||
| C. | T1<T2,P1>P2,m+n<p△Η<0 | D. | T1>T2,P1<P2,m+n>p△Η>0 |
17.二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水.某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如图所示.请回答下列问题:

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到的目的是bc(填序号)
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是防倒吸(或安全瓶),设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式SO2+Br2+2H2O=4H++SO42-+2Br-,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成表:(已知酸性:H2SO3>H2CO3>HClO)
(4)设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.

(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到的目的是bc(填序号)
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是防倒吸(或安全瓶),设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式SO2+Br2+2H2O=4H++SO42-+2Br-,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成表:(已知酸性:H2SO3>H2CO3>HClO)
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
4.同温下,向甲(保持恒容)乙(保持恒压)两个容器中分别加入物质的量均为1mol的A与发生可逆反应A(g)+B(g)?C(g),起始时两容器的体积相等,达到平衡状态后,下列说法正确的是( )
| A. | 容器甲中分子总数多 | B. | 容器甲中C的浓度大 | ||
| C. | 容器甲中反应速率快 | D. | 容器甲中转化率大 |
19.苹果酸的结构简式为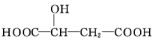 ,下列说法正确的是( )
,下列说法正确的是( )
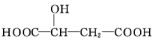 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸不能发生聚合反应 | |
| B. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
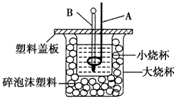 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量. .
.
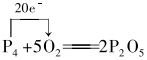 .
.