题目内容
17.二氧化硫常温下为无色有刺激性气味的有毒气体,易液化,易溶于水.某同学设计如下实验方案,对二氧化硫的化学性质进行探究,装置如图所示.请回答下列问题:
(1)反应结束时烧瓶中Cu由剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到的目的是bc(填序号)
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(2)装置B的作用是防倒吸(或安全瓶),设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式SO2+Br2+2H2O=4H++SO42-+2Br-,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能情况:
I.HSO3-与ClO-刚好反应完;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成表:(已知酸性:H2SO3>H2CO3>HClO)
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
分析 (1)证明H2SO4也有剩余,则可以检验H+或测定稀硫酸的pH确定稀硫酸的存在;
(2)B作安全瓶,可防止倒吸;溴水具有强氧化性,装置C可验证二氧化硫具有还原性,二氧化硫与溴水反应生成HBr和硫酸;结合二氧化硫具有漂白性分析;
(3)①加入几小块CaCO3固体,生成CO2气体,溶液显酸性;
②NaClO可氧化KI;
③溴水可氧化HSO3-;
④HSO3-与高锰酸钾可发生氧化还原反应;
(4)电离显酸性,水解显碱性,则测定pH即可.
解答 解:(1)a.用酸碱中和滴定法测定,由于溶液中存在的铜离子与氢氧根离子反应,无法测定硫酸的量,故a错误;
b.反应后剩余的氢离子与足量Zn反应生成氢气,通过测量生成H2的体积可确定硫酸的量,故b正确;
c.用pH计测溶液pH值,可以确定氢离子浓度,然后可计算出硫酸的量,故c正确;
d.由于硫酸根离子与氯化钡反应,无法用BaCl2溶液测定剩余硫酸的量,故d错误;
故答案为:bc;
(2)B装置的集气瓶是空的,可以防止倒吸;
C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;
装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,
故答案为:防倒吸(或安全瓶);还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)①加入几小块CaCO3固体,生成CO2气体,溶液显酸性,可能是Ⅰ或Ⅱ;
②NaClO可氧化KI,则观察到溶液变为蓝色;
③溴水可氧化HSO3-,则观察到溴水褪色,
④HSO3-与高锰酸钾可发生氧化还原反应,由溶液为紫色可知,不存在HSO3-,则I或Ⅲ成立,
故答案为:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | Ⅰ或Ⅱ | ||
| ② | 溶液变为黄色 | ||
| ③ | 溴水褪色 | ||
| ④ | Ⅰ或Ⅲ |
故答案为:常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.
点评 本题考查性质实验方案的设计,为高频考点,题目难度中等,把握制备实验装置、原理、物质的性质为解答的关键,侧重分析与实验能力的考查,有利于提高学生的分析、理解能力及灵活应用能力.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即:
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
| A. | CH4和C2H4 | B. | 烷烃和环烷烃 | C. | C3H8和C5H12 | D. | C2H4和C4H8 |
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
| A. | 若增大压强,则物质Y的转化率减小 | |
| B. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| C. | 若升高温度,X的体积分数增大,则该反应的△H>0 | |
| D. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 |
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 稳定性:NH3>PH3>AsH3 | |
| D. | 还原性强弱:F->Cl->Br |
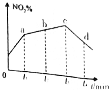 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应: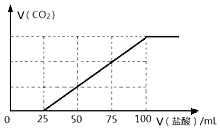 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.