题目内容
1.将标准状况下的2.24升氯气通入200g20%的溴化钠溶液中,求:(1)可生成多少克单质溴?
(2)将上述反应后所得混合溶液蒸发至干后,剩余固体混合物的成分是什么?质量分别是多少克?
分析 根据m(溶质)=m(溶液)×A%计算NaBr的质量,再根据n=$\frac{m}{M}$计算NaBr、氯气的物质的量,发生反应2NaBr+Cl2=Br2+2NaCl,根据反应方程式结合氯气、溴化钠的物质的量,判断氯气、溴化钠谁过量,然后根据参加反应的氯气求解;
(1)根据m=nM计算单质溴的质量;
(2)结合参加反应的NaBr、生成的NaCl的物质的量解答.
解答 解:(1)NaBr的质量=200g×20%=40g,n(NaBr)=$\frac{m}{M}$=$\frac{40g}{89g/mol}$=0.5mol,n(Cl2)=$\frac{2.24L}{22.4L}$=0.1mol,
2NaBr+Cl2 =Br2 +2NaCl
2mol 1mol 1mol 2mol
n(NaBr) n(Cl2) n(Br2) n(NaCl)
因 $\frac{2mol}{\frac{40}{89}mol}<\frac{1mol}{0.1mol}$,所以溴化钠过量,以氯气的量进行计算,所以$\frac{2mol}{n(NaBr)}$=$\frac{1mol}{0.1mol}$=$\frac{1mol}{n(B{r}_{2})}$=$\frac{2mol}{n(NaCl)}$
解得:n(NaBr)=0.2mol,n(Br2)=0.1mol,n(NaCl)=0.2mol,
(1)生成溴单质 n(Br2)=0.1mol,m(Br2)=n×M=0.1mol×160g/mol=16g,
答:生成溴单质为16克;
(2)反应后溶液中,剩余NaBr的质量=40g-0.2mol×103g/mol=19.4g,n(NaCl)=0.2mol,m(NaCl)=0.2mol×58.5g/mol=11.7g,n(Br2)=0.1mol,溴单质为易挥发的液体,将上述反应后所得混合溶液蒸发至干后,所得固体为溴化钠和氯化钠的混合物,其质量分别为:m(NaBr)=19.4g,m(NaCl)=11.7g,
答:剩余固体混合物的成分是溴化钠和氯化钠;m(NaBr)=19.4g,m(NaCl)=11.7g.
点评 本题考查根据方程式进行的计算,判断氯气、溴化钠哪种物质过量是解答本题的关键,题目难度中等.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| 装置 | 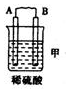 | 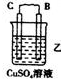 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
| A. | 70 mL | B. | 60mL | C. | 80 mL | D. | 128 mL |
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 稳定性:NH3>PH3>AsH3 | |
| D. | 还原性强弱:F->Cl->Br |
| A. | 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,则碳的燃烧热为110.5KJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-akJ/mol II:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol |
| A. | 食盐溶化 | B. | 干冰升华 | ||
| C. | 氯化铵受热,固体消失 | D. | 石墨熔化 |



