题目内容
18.白磷易溶于二硫化碳(二硫化碳易挥发且有毒,沸点46.5℃),不溶于水,在空气中易自燃.回答下列问题:(1)白磷是一种危险化学品,其包装上的安全标志是BC(填字母).

(2)已知白磷的化学式为P4,燃烧产物是P2O5.写出白磷自燃的化学方程式,并用单线桥法标出电子转移的方向和数目:
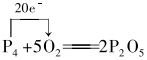 .
.(3)下列各组化学物质中能与白磷划为同一类的是AD(填字母).
A.O2、N2、C12 B.CuO、FeO、MgO C.H2O、NaOH、CO2 D.H2、O3、Na、Al
(4)二硫化碳燃烧的化学方程式为CS2+3O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2SO2.常温下,若使二硫化碳在一定量的氧气中恰好完全燃烧,最终得到a L混合气体,则起始时氧气的体积为aL(以同温同压测定).
分析 (1)白磷有剧毒,着火点比较低,易自然;
(2)白磷与氧气反应生成五氧化二磷,P的化合价从0价升高到+5价;
(3)白磷属于单质;
(4)CS2+3O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2SO2反应中生成的气体的物质的量等于消耗的氧气的物质的量.
解答 解:(1)白磷有剧毒,着火点比较低,易自然,所以包装上的安全标志是自然物品、剧毒物质;
故答案为:BC;
(2)白磷与氧气反应生成五氧化二磷,P的化合价从0价升高到+5价,4个P原子转移20个电子,则单线桥法标出电子转移的方向和数目为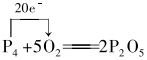 ;
;
故答案为: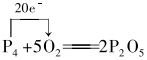 ;
;
(3)A.O2、N2、C12 都是单质,能与白磷划为同一类,故A正确;
B.CuO、FeO、MgO 都是氧化物,属于化合物,不能与白磷划为同一类,故B错误;
C.H2O、NaOH、CO2 属于化合物,不能与白磷划为同一类,故C错误;
D.H2、O3、Na、Al都是单质,能与白磷划为同一类,故D正确;
故答案为:AD;
(4)CS2+3O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2SO2反应中生成的气体的物质的量等于消耗的氧气的物质的量,常温下,若使二硫化碳在一定量的氧气中恰好完全燃烧,最终得到a L混合气体,则消耗的氧气为aL;
故答案为:a.
点评 本题考查了氧化还原反应、磷的性质、有关方程式的计算,题目难度不大,明确氧化还原反应中元素的化合价变化、磷的性质是解答本题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
8.某同学对铁的氧化物产生浓厚兴趣,查阅资料后得到以下信息:
在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即: 下列说法正确的是( )
下列说法正确的是( )
在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即:
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
9.已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
6.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 稳定性:NH3>PH3>AsH3 | |
| D. | 还原性强弱:F->Cl->Br |
3.下列物质属于电解质的是( )
| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | Na2CO3溶液 |
10.下列说法正确的是( )
| A. | 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,则碳的燃烧热为110.5KJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-akJ/mol II:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol |
8.二甲醚(CH3OCH3)-空气燃料电池的工作原理如图所示.电池工作时,下列说法正确的是( )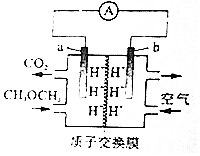

| A. | a极区域溶液的pH变大 | |
| B. | b极有H2O生成 | |
| C. | a极反应式:CH3OCH3+3O2--12e-═2CO2↑+6H+ | |
| D. | 每消耗11.2LO2(标准状况).有2molH+向左侧移动 |




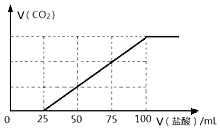 向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.
向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.