题目内容
20.肼(N2H4)-空气燃料电池以KOH溶液为电解质溶液,装置如图所示.下列有关叙述正确的是( )
| A. | 放电时,电流从b极经过负载流向a极 | |
| B. | b极发生氧化反应 | |
| C. | a极的反应式为N2H4+4OH--4e-=N2+4H2O | |
| D. | 电池中的离子交换膜需选用阳离子交换膜 |
分析 该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向分析解答.
解答 解:A.该燃料电池中,通入氧化剂空气的电极b为正极,a为负极,放电时,电流从正极b经过负载流向a极,故A正确;
B.该燃料电池中,通入氧化剂空气的电极b为正极,正极上氧气得电子发生还原反应,故B错误;
C.通入燃料的电极为负极,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,故C正确;
D.该原电池中,正极上生成氢氧根离子,所以离子交换膜要选取阴离子交换膜,故D错误;
故选AC.
点评 本题考查了燃料电池,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写,注意电流的方向和电子的流向相反,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| B. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| C. | 用活性炭为糖脱色和用臭氧白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
11.下列能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ①②④⑤ | B. | ①②③⑥ | C. | ①③⑤⑥ | D. | ①③④⑥ |
15.同温同压下,KMnO4、KClO3、H2O2分解产生相同体积的氧气,三个反应中转移的电子数之比为( )
| A. | 1:1:l | B. | 1:1:2 | C. | 2:2:1 | D. | 4:3:2 |
5. 有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
 有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该有机物与足量溴水反应最多消耗3molBr2 | |
| C. | 1 mol该有机物最多能与2 mol NaOH反应 | |
| D. | 该有机物若能使酸性KMnO4溶液褪色,则可证明其分子中存在碳碳双键 |
9.下列实验方案、现象和结论均正确的是( )
| 选项 | A | B | C | D |
| 实验方案 | 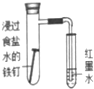 | 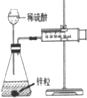 | 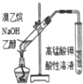 | 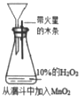 |
| 现象 | 导管中有红色柱 | 注射器的活塞往外推 | 高锰酸钾酸性溶液褪色 | 带火星的木条复燃 |
| 结论或作用 | 证明铁钉发生吸氧腐蚀 | 可用于测定反应物浓度对反应速率的影响 | 溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯 | MnO2可与H2O2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |