题目内容
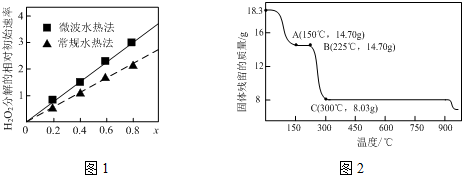
5. 有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )
有机物X由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线表示单键或双键).关于该有机物叙述正确的是( )| A. | 分子中含有3种官能团 | |
| B. | 1 mol该有机物与足量溴水反应最多消耗3molBr2 | |
| C. | 1 mol该有机物最多能与2 mol NaOH反应 | |
| D. | 该有机物若能使酸性KMnO4溶液褪色,则可证明其分子中存在碳碳双键 |
分析 根据原子成键特点知,该分子中含有苯环、酚羟基、酯基、碳碳双键,具有苯、酚、酯、烯烃的性质,能发生加成反应、取代反应、氧化反应、水解反应等,据此分析解答.
解答 解:A.根据原子成键特点知,该分子中酚羟基、酯基、碳碳双键3种官能团,故A正确;
B.苯环上酚羟基邻对位氢原子能被溴取代,碳碳双键能和溴发生加成反应,所以1 mol该有机物与足量溴水反应最多消耗3molBr2,故B正确;
C.酚羟基、酯基水解生成的酚羟基和羧基都能和NaOH反应,所以1 mol该有机物最多能与3mol NaOH反应,故C错误;
D.碳碳双键、酚羟基、连接苯环的碳原子上含有氢原子的能被酸性高锰酸钾溶液氧化,所以不能根据酸性高锰酸钾溶液褪色确定含有碳碳双键,故D错误;
故选AB.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,易错点是碳碳双键的判断,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
15.常温下,向稀醋酸中不断加水稀释,始终保持不变的是( )
| A. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | B. | $\frac{c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ | ||
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | D. | $\frac{c({H}^{+})•c(C{H}_{2}CO{O}^{-})}{c(C{H}_{3}COOH)}$ |
16.在一定条件下的定容密闭容器中,下列说法能表明反应A(s)+2B(g)═C(g)+D(g) 已达平衡状态的是( )
| A. | 混合气体的压强不再改变 | |
| B. | 单位时间内生成n mol A的同时,生成2n mol的B | |
| C. | C的生成速率是B 的生成速率的两倍 | |
| D. | 混合气体的密度不再改变 |
13.化学与生产生活密切相关,下列说法正确的是( )
| A. | 醋酸可用于清除水垢 | B. | 蛋白质遇碘水显蓝色 | ||
| C. | 液化石油气的主要成份为CH4 | D. | 煤的液化属于物理变化 |
20.肼(N2H4)-空气燃料电池以KOH溶液为电解质溶液,装置如图所示.下列有关叙述正确的是( )

| A. | 放电时,电流从b极经过负载流向a极 | |
| B. | b极发生氧化反应 | |
| C. | a极的反应式为N2H4+4OH--4e-=N2+4H2O | |
| D. | 电池中的离子交换膜需选用阳离子交换膜 |
14.下列有关氧元素及其化合物的表示或说法正确的是( )
| A. | 氧原子的原子结构示意图: | |
| B. | 羟基的结构式:O-H | |
| C. | 用电子式表示Na2O的形成过程: | |
| D. | 组成为C2H6O的分子中可能只存在极性键 |
15.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 常温常压下,l.6g${\;}_{6}^{14}$CH4中含有共价键总数为0.4NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |