题目内容
10.肼(N2H4)是一种重要的液态火箭燃料,具有弱碱性和强还原性.工业上利用尿素[CO(NH2)2]、NaC1O在NaOH溶液中发生反应生成水合肼(N2H4•H2O)、Na2CO3等产物.请回答:(1)上述生成水合肼的反应中尿素是还原剂( 填“氧化剂”或“还原剂”),反应的化学方程式为CO(NH2)2+NaClO+2NaOH=N2H4•H2O+Na2CO3+NaCl.
(2)肼与盐酸反应可生成N2H6C12,N2H6C12的水溶液显酸性( 填“酸”或“碱”或“中”),用离子方程式表示其原因N2H62++2H2O?N2H4•2H2O+2H+.
(3)查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜.取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在高温下恰好完全反应生成氮气等产物,写出该反应的化学方程式3N2H4+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$3N2+4Fe+6H2O.
若要设计实验方案检验上述反应生成固体产物中的金属离子,补充完整下列实验步骤:
①所得固体溶入浓盐酸中;
②先加入双氧水、再加硫氰化钾.
分析 (1)根据反应物与生成物来书写化学反应方程式,元素化合价升高的反应物为还原剂;
(2)N2H6C12为强酸弱碱盐,水解呈酸性;
(3)肼与氧化铁在高温条件下反应生成氮气、水、铁单质;②根据亚铁离子的性质设计检验方案.
解答 解:(1)尿素和次氯酸钠-氢氧化钠溶液反应生成肼、碳酸钠、氯化钠、水,该化学反应方程式为CO(NH2)2+NaClO+2NaOH=N2H4•H2O+Na2CO3+NaCl,该反应中:CO(NH2)2中N(-3)→N2H4•H2O中N(-2)为还原剂,NaClO中Cl(+1→-1)为氧化剂,
故答案为:还原剂;CO(NH2)2+NaClO+2NaOH=N2H4•H2O+Na2CO3+NaCl;
(2)N2H6C12为强酸弱碱盐,水解呈酸性,水解方程式为:N2H62++2H2O?N2H4•2H2O+2H+,
故答案为:酸;N2H62++2H2O?N2H4•2H2O+2H+;
(3)肼与氧化铁在高温条件下反应生成氮气、水、铁单质,方程式为:3N2H4+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$3N2+4Fe+6H2O,
故答案为:3N2H4+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$3N2+4Fe+6H2O;
②铁与盐酸反应生成氯化铁和氢气,离子方程式为Fe+2H+═Fe2++H2↑,检验亚铁离子,双氧水能氧化亚铁离子生成铁离子,铁离子能与硫氰化钾反应生成血红色物质,
故答案为:Fe+2H+═Fe2++H2↑;先加入双氧水、再加硫氰化钾.
点评 本题考查较为综合,涉及方程式书写、氧化还原、离子的检验等知识,题目难度中等,注意相关题干信息的应用.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
20.肼(N2H4)-空气燃料电池以KOH溶液为电解质溶液,装置如图所示.下列有关叙述正确的是( )

| A. | 放电时,电流从b极经过负载流向a极 | |
| B. | b极发生氧化反应 | |
| C. | a极的反应式为N2H4+4OH--4e-=N2+4H2O | |
| D. | 电池中的离子交换膜需选用阳离子交换膜 |
1.对二甲苯(PX)可发生如下反应生成对苯二甲酸(PTA).下列有关说法错误的是( )
 +12MnO${\;}_{4}^{-}$+36H+→
+12MnO${\;}_{4}^{-}$+36H+→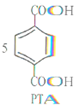 +12Mn2++28H2O.
+12Mn2++28H2O.
 +12MnO${\;}_{4}^{-}$+36H+→
+12MnO${\;}_{4}^{-}$+36H+→ +12Mn2++28H2O.
+12Mn2++28H2O.| A. | PTA是该反应的氧化产物 | B. | 消耗1molPX,共转移8mol电子 | ||
| C. | PX含苯环的同分异构体还有3种 | D. | PTA与乙二醇可以发生缩聚反应 |
18.分类法是研究化学的一种重要方法,下列物质归类有错的是( )
| A. | 氧化性酸:HNO3、H3PO4、HClO4 | |
| B. | 干燥剂:碱石灰、硅胶、无水氯化钙 | |
| C. | 酸性氧化物:SiO2、Cl2O、CrO3 | |
| D. | 危险化学品:天然气、金属钠、氯酸钾 |
5.下列说法正确的是( )
| A. | 沸点由低到高的顺序为:CH3CH2CH3<CH3(CH2)2CH3<(CH3)3CH | |
| B. | 工业上合成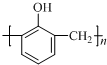 的单体为甲醛和苯酚( 的单体为甲醛和苯酚(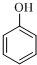 ) ) | |
| C. | 相同质量的乙烯和乙酸完全燃烧时,消耗氧气的量相同 | |
| D. | 某烷烃可以命名为2,3,3-三甲基-4-乙基戊烷 |
15.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 常温常压下,l.6g${\;}_{6}^{14}$CH4中含有共价键总数为0.4NA | |
| B. | 密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA | |
| C. | 1 L 0.lmol•L-1的CH3COONa溶液中CH3COO-和CH3COOH粒子数之和为0.1NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
2.高能糖电池是一种新型的电池,该电池解决了环境污染问题,有望在未来代替传统电池.该电池的工作原理为C6H12O6(葡萄糖)+6O2$\frac{\underline{\;\;\;\;\;\;\;酸\;\;\;\;\;\;\;}}{酸性介质}$6CO2+6H2O,下列有关说法正确的是( )
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+2H2O+4e-═4OH- | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,电解质溶液的pH增大 |
6.H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式:2H2O2$\frac{\underline{\;Fe_{2}(SO_{4})_{3}\;}}{\;}$2H2O+O2↑.
②设计实验方案:在不同H2O2浓度下,测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
④查阅资料,30%的H2O2的密度为1.13g/mL,若实验测得实验2中H2O2全部分解所需的时间为2min,则用H2O2表示该反应在2min内的平均速率为3.75mol?L-1?min-1(设溶液体积变化忽略不计)
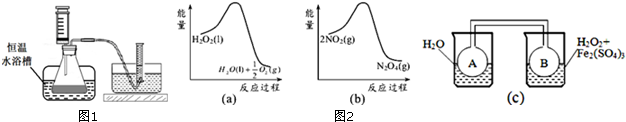
(2)利用图2-(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是由图(a)可知H2O2分解为放热反应,H2O2分解使B瓶中温度升高,再由图(b)可知反应2NO2(g) N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
(1)某化学活动小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.所用试剂:30%H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水.
①写出实验中H2O2分解反应方程式:2H2O2$\frac{\underline{\;Fe_{2}(SO_{4})_{3}\;}}{\;}$2H2O+O2↑.
②设计实验方案:在不同H2O2浓度下,测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少(要求所测得的数据能直接体现反应速率大小).
③根据上述实验要求,请将表格补充完整.
物理量 实验序号 | 0.1mol?L-1Fe2(SO4)3 的体积/mL | 30% H2O2 的体积/mL | H2O 的体积/mL |
| 1 | 0.5 | 15 | 24.5mL |
| 2 | 0.5 | 30 | 9.5 |
(2)利用图2-(a)和(b)中的信息,按图(c)装置(连接的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是由图(a)可知H2O2分解为放热反应,H2O2分解使B瓶中温度升高,再由图(b)可知反应2NO2(g)
 N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
N2O4(g),也是放热反应,升温使平衡向左移动,C(NO2)增大,颜色加深.
 .
.