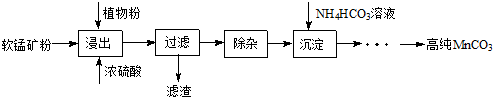
题目内容
12.氮、磷及其化合物在科研及生产中均有着重要的应用.(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式:Fe+4H++NO3-=Fe3++NO↑+2H2O
(2)LiFePO4是一种新型动力锂电池的电极材料.
①图1为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式:Li++FePO4+e-=LiFePO4.
②将LiOH、FePO4•2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4.焙烧过程中N2的作用是防止生成的Fe2+在空气中重新被氧化;实验室中以Fe3+为原料制得的FePO4•2H2O有时显红褐色,FePO4•2H2O中混有的杂质可能为Fe(OH)3(或氢氧化铁).
(3)磷及部分重要化合物的相互转化如图2所示.
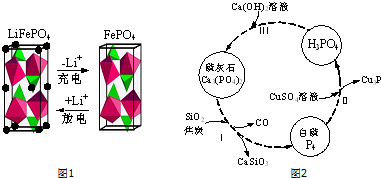
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是做还原剂.
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1molCuSO4所能氧化的白磷的物质的量为0.05mol.
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有CaHPO4、Ca(H2PO4)2.
分析 (1)铁和过量稀硝酸反应生成硝酸铁、一氧化氮和水;
(2)①在原电池放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,根据得失电子确定正负极,根据反应物、生成物书写电极反应式.
②制备锂电池正极材料LiFePO4.需要防止亚铁被氧化分析判断;红褐色可能是晶体在下层了氢氧化铁胶体;
(3)①依据发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,判断CO的作用;
②依据氧化还原反应中铜元素、磷元素化合价变化计算;
③磷酸为三元酸与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能是:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2.
解答 解:(1)铁和过量稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)①放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:Li++FePO4+e-=LiFePO4;
②制备锂电池正极材料LiFePO4.需要防止亚铁被氧化分析,焙烧过程中N2的作用是防止生成的Fe2+在空气中重新被氧化;红褐色可能是晶体在下层了氢氧化铁胶体,
故答案为:防止生成的Fe2+在空气中重新被氧化;Fe(OH)3(或氢氧化铁);
(3)①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,反应中C中的碳化合价升高,做还原剂,
故答案为:做还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(5-0)=1mol×(2-1),解得n=$\frac{1}{20}$mol=0.05mol,
故答案为:0.05mol;
③磷酸为三元酸与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能是:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2,
故答案为:CaHPO4、Ca(H2PO4)2.
点评 本题依据N、P及其化合物的转化为情境考查了氧化还原反应的概念及有关计算,原电池原理分析应用,抓住氧化还原反应得失电子守恒是解题关键,题目难度较大.

 备战中考寒假系列答案
备战中考寒假系列答案 ,该分子中官能团(不含苯环)不含有( )
,该分子中官能团(不含苯环)不含有( )| A. | 酯基 | B. | 碳碳双键 | C. | 醚键 | D. | 硝基 |
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.5mol/L亚硫酸钠溶液中含有的SO32-的物质的量为0.5mol | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 过量铜片与100mL18mol/L的浓硫酸反应,转移的电子数为1.8NA |

| A. | 放电时,电流从b极经过负载流向a极 | |
| B. | b极发生氧化反应 | |
| C. | a极的反应式为N2H4+4OH--4e-=N2+4H2O | |
| D. | 电池中的离子交换膜需选用阳离子交换膜 |
| A. | N2O结构式可表示为N=N=O | |
| B. | O3分子呈直线形 | |
| C. | CH2=CH-CHO分子中碳原子均采用sp2杂化 | |
| D. | 相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
| A. | Na+、Fe3+是人体所需微量元素 | B. | 苯酚不能用于杀菌消毒 | ||
| C. | 氢气是未来的一种理想燃料 | D. | 乙醇是不可再生的生物质能源 |
 +12MnO${\;}_{4}^{-}$+36H+→
+12MnO${\;}_{4}^{-}$+36H+→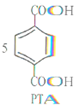 +12Mn2++28H2O.
+12Mn2++28H2O.| A. | PTA是该反应的氧化产物 | B. | 消耗1molPX,共转移8mol电子 | ||
| C. | PX含苯环的同分异构体还有3种 | D. | PTA与乙二醇可以发生缩聚反应 |
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+2H2O+4e-═4OH- | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,电解质溶液的pH增大 |