题目内容
6.正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )| A. | H2、D2互为同位素 | |
| B. | 氨分子中的化学键都为非极性共价键 | |
| C. | NH4Cl的电子式: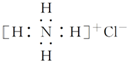 | |
| D. | S2-的结构示意图: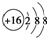 |
分析 A.同位素研究对象为核素;
B.氨气分子中存在3个N-H键,氮氢键为极性共价键;
C.氯离子没有标出最外层电子;
D.硫离子核内有16个质子,核外有18个电子,最外层有8个电子;
解答 解:A.H2、D2是单质,不是同位素,故A错误;
B.氨气分子中的化学键为N-H键,属于极性共价键,氨气分子中不存在非极性共价键,故B错误;
C.氯化铵中存在铵根离子和氯离子,电子式中既要标出离子所带电荷,还要标出最外层电子,氯化铵正确的电子式为: ,故C错误;
,故C错误;
D.硫离子核电荷数为16,最外层为8个电子,硫离子的结构示意图为: ,故D正确;
,故D正确;
故选:D.
点评 本题考查了常见化学用语的使用方法,涉及电子式、离子结构示意图、共价键的类型、同素异形体与同位素的判断,注意掌握常见化学用语的概念及正确的表示方法,明确同位素与同系物、同素异形体的区别,明确离子化合物与共价化合物的电子式的正确表示方法即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.可用如图装置制取(必要时可加热)、净化、收集的气体是( )


| A. | 铜和稀硝酸制一氧化氮 | B. | 亚硫酸钠与浓硫酸制二氧化硫 | ||
| C. | 锌和稀硫酸制氢气 | D. | 烧碱固体与浓氨水制氨气 |
14.反应2A(g)?2B(g)+C(g)△H>0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是( )
| A. | 减压 | B. | 降温 | C. | 加压 | D. | 增大B的浓度 |
1.某原电池的总反应的离子方程式为:Zn+Cu2+═Zn2++Cu,则该原电池的正确组成可以是下列的( )
| A. | 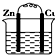 CuSO4溶液 | B. | 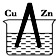 ZnSO4溶液 | ||
| C. | 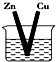 酒精 | D. |  |
18. X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y与Z形成的化合物都可以和盐酸反应 | |
| C. | 简单阴离子的还原性:Y>W | |
| D. | Z与Q形成的化合物水溶液一定显酸性 |
18.关于卤素的下列叙述正确的是( )
| A. | 卤素是典型的非金属元素,因此不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其熔、沸点就越高 | |
| C. | 卤素单质都能和水剧烈反应 | |
| D. | 卤素单质都能和H2反应,且气态氢化物的稳定性随单质氧化性的增强而增强 |
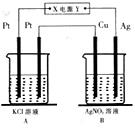 如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:
如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答: