题目内容
15. 如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:
如图所示,常温下电解5min后,铜电极质量增加1,08g,试回答:(1)电源电极Y的名称为正极(填正极或负极)
(2)电解池B中阴极的电极反应式是Ag++e-═Ag.
(3)若A中KC1溶液的体积是100mL,电解后溶液的pH=13(忽略电解前后溶液体积的变化).
(4)若要使电解后的溶液恢复到与电解前完全相同,应加入的物质是HCl其物质的量为0.01mol.
分析 (1)常温下电解5min后,铜电极质量增加1.08g,则Cu电极是阴极,Ag电极是阳极,连接阳极的电极是电源正极、连接阴极的电极是电源负极;
(2)B中阴极上银离子放电生成银单质;
(3)根据转移电子相等计算A中生成氢氧根离子浓度,从而计算溶液的pH;
(4)根据“析出什么加入什么”的原则加入物质.
解答 解:(1)常温下电解5min后,铜电极质量增加1.08g,则Cu电极是阴极,Ag电极是阳极,连接阳极的电极是电源正极、连接阴极的电极是电源负极,所以X是电源负极、Y是正极,
故答案为:正极;
(2)B中阴极上银离子放电生成银单质,电极反应式为Ag++e-═Ag,故答案为:Ag++e-═Ag;
(3)常温下电解5min后,铜电极质量增加1.08g,转移电子的物质的量=$\frac{1.08g}{108g/mol}$=0.01mol,A中电池反应式为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2KOH,根据转移电子相等知c(KOH)=$\frac{\frac{0.01mol}{2×2}}{0.1L}$=0.1mol/L,则溶液中c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13 mol/L,所以pH=13,故答案为:13;
(4)阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,所以相当于析出HCl,根据“析出什么加入什么”的原则知,若要使电解后的溶液恢复到与电解完完全相同,应加入的物质是HCl,当生成1mol氢气和1mol氯气时,转移2mol电子,故转移0.01mol电子时,分别生成0.005mol氢气和氯气,故需要加入0.01HCl,故答案为:HCl;0.01mol.
点评 本题考查较综合,涉及电解原理知识点,明确离子放电顺序是解本题关键,再结合转移电子守恒进行解答,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 元素周期表共有18个族 | |
| B. | 含有元素种类最多的族是第ⅠA 族 | |
| C. | 含有元素种类最多的周期是第六周期 | |
| D. | 第五周期有14种金属元素 |
| A. | H2、D2互为同位素 | |
| B. | 氨分子中的化学键都为非极性共价键 | |
| C. | NH4Cl的电子式: | |
| D. | S2-的结构示意图: |
| A. | X与W的最高正价之和为11 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | 原子半径由大到小的顺序为W、Z、Y、X | |
| D. | Y分别与X、Z形成的化合物中化学键类型相同 |
| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |

| A. | 区分淀粉溶液和鸡蛋清溶液 | B. | 鉴别乙酸和乙醇 | ||
| C. | 鉴别自来水与豆浆 | D. | 鉴别乙酸乙酯与饱和Na0H溶液 |
| A. | 油脂在体内完全氧化时,提供的能量比糖类和蛋白质约高一倍 | |
| B. | 利用油脂在碱性条件下水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化,即与氢气发生加成反应,可以制造植物奶油(人造奶油) | |
| D. | 天然油脂没有固定的熔沸点 |
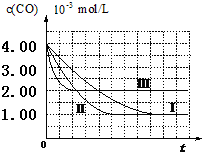 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
| A. | MgO | B. | Na2O2 | C. | CaCl2 | D. | NH4Cl |