题目内容
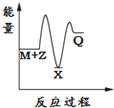
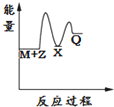
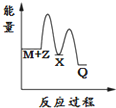
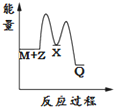
14.反应2A(g)?2B(g)+C(g)△H>0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是( )| A. | 减压 | B. | 降温 | C. | 加压 | D. | 增大B的浓度 |
分析 要使逆反应速率降低,则减小浓度、温度、压强等,而同时保证A的浓度增大,平衡应逆向移动,结合反应为气体体积增大的吸热反应来解答.
解答 解:A.减压,反应速率减小,但平衡正向移动,A的浓度减小,故A不选;
B.降温,反应速率减少,且平衡逆向移动,A的浓度增大,故B选;
C.加压,反应速率增大,平衡逆向移动,故C不选;
D.增大B的浓度,反应速率加快,平衡逆向移动,故D不选;
故选B.
点评 本题考查化学反应速率的影响因素及化学平衡移动,为高频考点,把握影响速率的因素及影响平衡移动的因素为解答的关键,侧重分析与应用能力的考查,注重迁移应用能力的训练,题目难度不大.

练习册系列答案
相关题目
4.氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O;正极分压式为O2+4e-+2H2O=4OH-.
(2)下列措施可以加快合成氨反应速率的是ACDE.
A.通过缩小容器的容积增大压强
B.及时将氨液化分离出去
C.适当升温
D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到25min时,①以N2表示的平均反应速率为0.01mol/(L.min);②H2的平衡转化率为50%;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g);△H=+116kJ•mol-1
③H2O(l)═H2O(g);△H=+44kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式CO2(g)+2NH3(g)=CO(NH2)2(S)+H2O(1)△H=-87.47kJ/mol.
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O;正极分压式为O2+4e-+2H2O=4OH-.
(2)下列措施可以加快合成氨反应速率的是ACDE.
A.通过缩小容器的容积增大压强
B.及时将氨液化分离出去
C.适当升温
D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g);△H=+116kJ•mol-1
③H2O(l)═H2O(g);△H=+44kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式CO2(g)+2NH3(g)=CO(NH2)2(S)+H2O(1)△H=-87.47kJ/mol.
5.下列关于元素周期表的叙述中正确的是( )
| A. | 元素周期表共有18个族 | |
| B. | 含有元素种类最多的族是第ⅠA 族 | |
| C. | 含有元素种类最多的周期是第六周期 | |
| D. | 第五周期有14种金属元素 |
9.容量瓶上不需要标明的是( )
| A. | 温度 | B. | 物质的量浓度 | C. | 规格 | D. | 刻度线 |
6.正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | H2、D2互为同位素 | |
| B. | 氨分子中的化学键都为非极性共价键 | |
| C. | NH4Cl的电子式: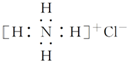 | |
| D. | S2-的结构示意图: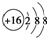 |
3.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是次外层的3倍,Z原子最外层只有1个电子,W的最低负价为-3.下列叙述正确的是( )
| A. | X与W的最高正价之和为11 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | 原子半径由大到小的顺序为W、Z、Y、X | |
| D. | Y分别与X、Z形成的化合物中化学键类型相同 |
6. (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
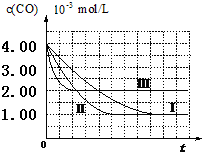
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.5×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.

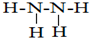 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.